Cargas formales
Las moléculas orgánicas también pueden tener cargas positivas o negativas asociadas. Durante las reacciones químicas, es común que el reactivo, los intermedios y/o los productos tengan cargas. Reconocer y distinguir entre patrones de enlace neutros y cargados será útil para aprender los mecanismos de reacción. Consideremos la estructura de Lewis del metanol, CH3OH (el metanol es el llamado «alcohol de madera» que los contrabandistas sin escrúpulos vendían a veces durante la época de la prohibición en los años 20, provocando a menudo que las personas que lo bebían se quedaran ciegas). El metanol en sí es una molécula neutra, pero puede perder un protón para convertirse en un anión molecular (CH3O-), o ganar un protón para convertirse en un catión molecular (CH3OH2+).

El anión y el catión molecular tienen cargas globales de -1 y +1, respectivamente. Pero podemos ser más específicos que eso: también podemos afirmar para cada ion molecular que una carga formal se localiza específicamente en el átomo de oxígeno, en lugar de en el carbono o en cualquiera de los átomos de hidrógeno.
Descubrir la carga formal de los diferentes átomos de una molécula es un proceso sencillo: se trata simplemente de sumar los electrones de valencia.
Un átomo de oxígeno no unido tiene 6 electrones de valencia. Sin embargo, cuando está unido como parte de una molécula de metanol, un átomo de oxígeno está rodeado por 8 electrones de valencia: 4 electrones no enlazados (dos «pares solitarios») y 2 electrones en cada uno de sus dos enlaces covalentes (uno con el carbono y otro con el hidrógeno). En la convención de carga formal, decimos que el oxígeno «posee» los 4 electrones no enlazantes. Sin embargo, sólo «posee» un electrón de cada uno de los dos enlaces covalentes, porque los enlaces covalentes implican compartir electrones entre átomos. Por lo tanto, el átomo de oxígeno del metanol posee 2 + 2 + (½ x 4) = 6 electrones de valencia.
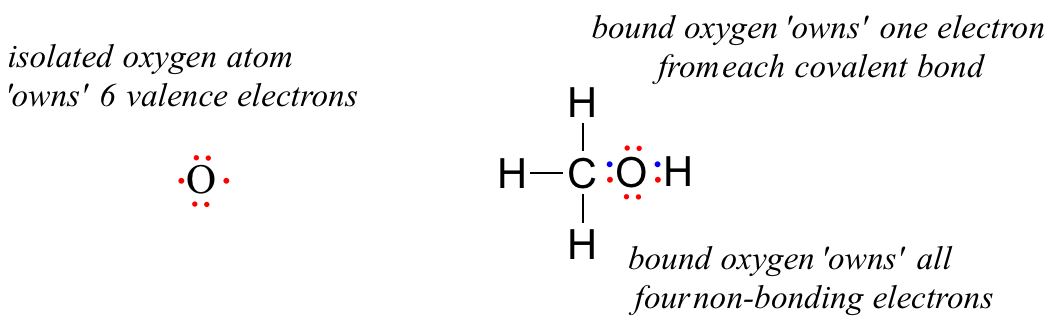
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
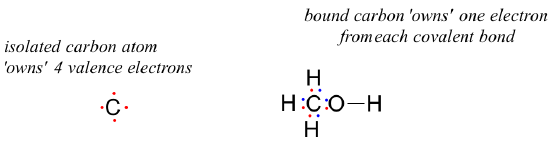
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
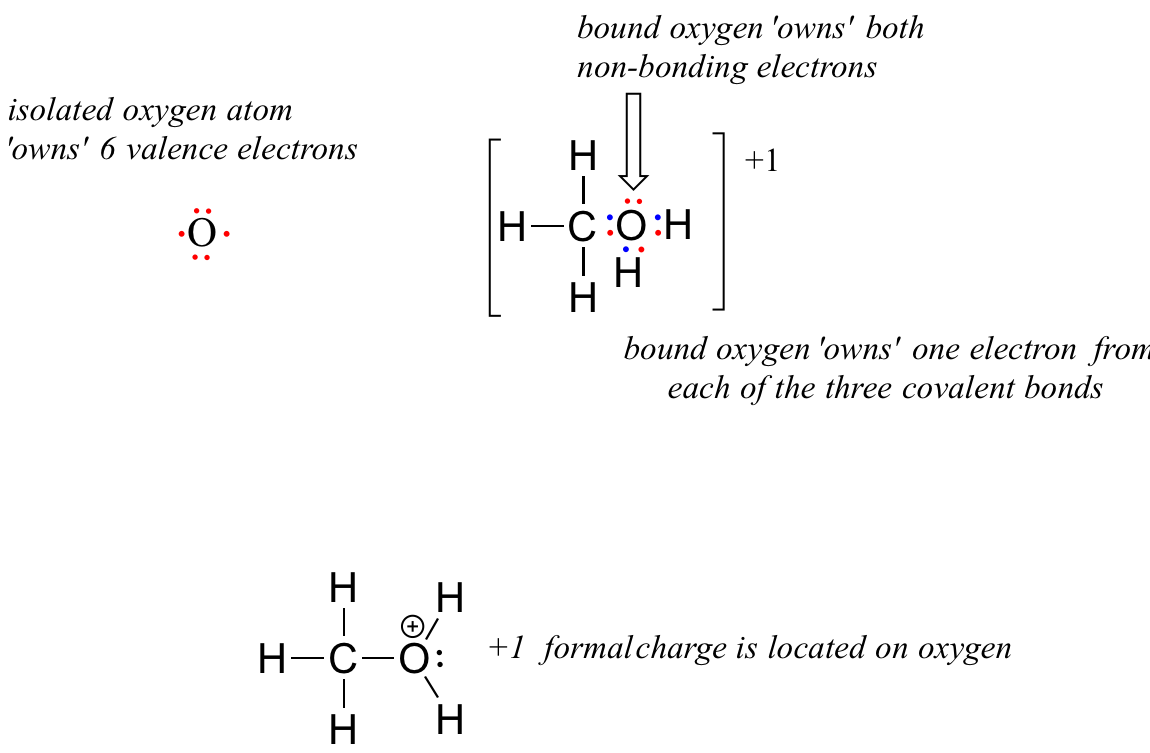
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
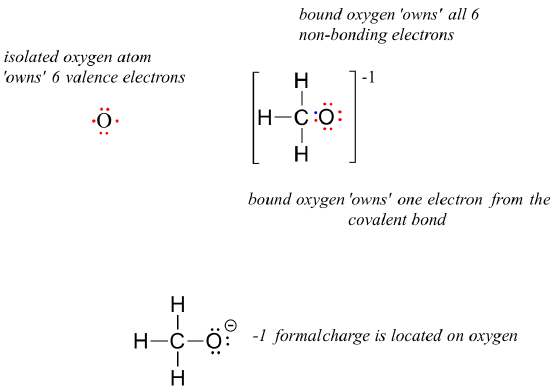
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Al dibujar las estructuras de las moléculas orgánicas, es muy importante mostrar todas las cargas formales no nulas, teniendo claro dónde se encuentran las cargas. Una estructura a la que le faltan cargas formales distintas de cero no está dibujada correctamente, ¡y probablemente será marcada como tal en un examen!
En este punto, pensando en lo que aprendiste en química general, probablemente te estés preguntando «¿Qué pasa con los dipolos? Acaso un átomo de oxígeno en un enlace O-H no «posee» más densidad de electrones que el hidrógeno, debido a su mayor electronegatividad?» Esto es absolutamente correcto, y revisaremos el concepto de dipolos de enlace más adelante. Sin embargo, a la hora de calcular las cargas formales, los dipolos de enlace no importan, ya que siempre consideramos que los dos electrones de un enlace se reparten por igual, aunque esto no sea un reflejo exacto de la realidad química. Las cargas formales son sólo eso, una formalidad, un método de contabilidad de electrones que está vinculado al sistema de Lewis para dibujar las estructuras de los compuestos orgánicos y los iones. Más adelante, veremos cómo el concepto de carga formal puede ayudarnos a visualizar cómo reaccionan las moléculas orgánicas.
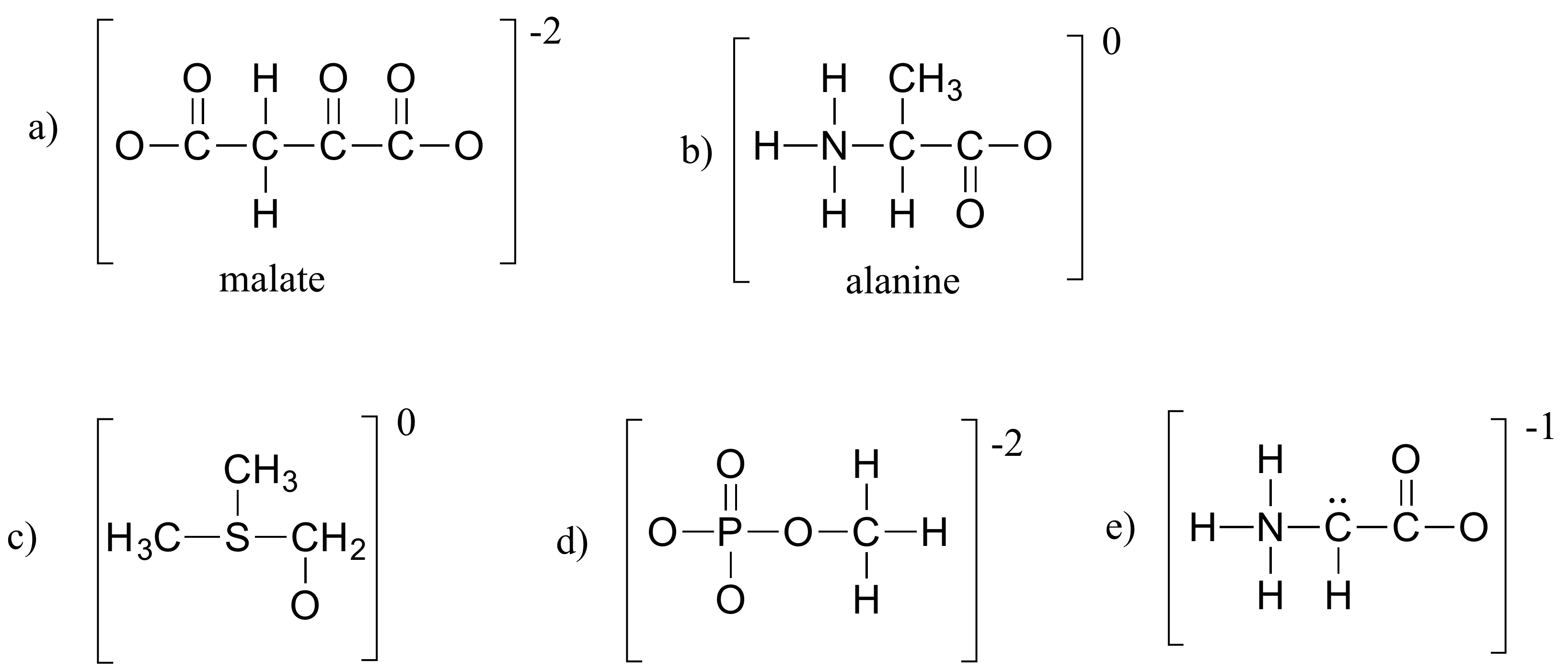
Por último, no se deje llevar por la idea de que sólo porque la carga neta de una estructura sea cero no hay átomos con cargas formales: un átomo podría tener una carga formal positiva y otro negativa, y la carga neta seguiría siendo cero. Los zwitteriones, como los aminoácidos, tienen cargas formales positivas y negativas en diferentes átomos:

Aunque la carga neta de la glicina es cero, es necesario mostrar la ubicación de las cargas formales positivas y negativas.
Ejercicio 1.4
Rellene todos los electrones del par solitario y las cargas formales que faltan en las estructuras siguientes. Suponga que todos los átomos tienen una capa de valencia completa de electrones. Las cargas netas se muestran fuera de los paréntesis.
Soluciones de los ejercicios