Electronegatividad y polaridad de enlace
Aunque hemos definido el enlace covalente como un intercambio de electrones, los electrones de un enlace covalente no siempre son compartidos por igual por los dos átomos enlazados. A menos que el enlace conecte dos átomos del mismo elemento, como en el H2, siempre habrá un átomo que atraiga los electrones del enlace con más fuerza que el otro átomo, como en el HCl, mostrado en la Figura \(\PageIndex{1}). Un enlace covalente que tiene un reparto equitativo de electrones (Figura \(\PageIndex{1a}\)) se denomina enlace covalente no polar. Un enlace covalente que tiene un reparto desigual de electrones, como en la Figura \PageIndex{1b}, se denomina enlace covalente polar.

La distribución de la densidad de electrones en un enlace polar es desigual. Es mayor alrededor del átomo que atrae los electrones más que el otro. Por ejemplo, los electrones en el enlace H-Cl de una molécula de cloruro de hidrógeno pasan más tiempo cerca del átomo de cloro que del átomo de hidrógeno. Obsérvese que el área sombreada alrededor del Cl en la Figura \PageIndex{1b}} es mucho mayor que alrededor del H.
Este desequilibrio en la densidad de electrones da lugar a una acumulación de carga parcial negativa (designada como δ-) en un lado del enlace (Cl) y una carga parcial positiva (designada como δ+) en el otro lado del enlace (H). Esto se ve en la Figura \N(\PageIndex{2a}\N). La separación de la carga en un enlace covalente polar da lugar a un dipolo eléctrico (dos polos), representado por la flecha en la Figura \ (\PageIndex{2b}\). La dirección de la flecha apunta hacia el extremo δ- mientras que la cola + de la flecha indica el extremo δ+ del enlace.
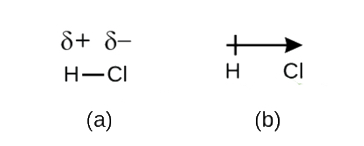
Figura \(\PageIndex{2}\): (a) El reparto desigual del par de electrones de enlace entre el H y el Cl conduce a una carga positiva parcial en el átomo de H y una carga negativa parcial en el Cl. Los símbolos δ+ y δ- indican la polaridad del enlace H-Cl. (b) El dipolo está representado por una flecha con una cruz en la cola. La cruz está cerca del extremo δ+ y la punta de la flecha coincide con el δ-.
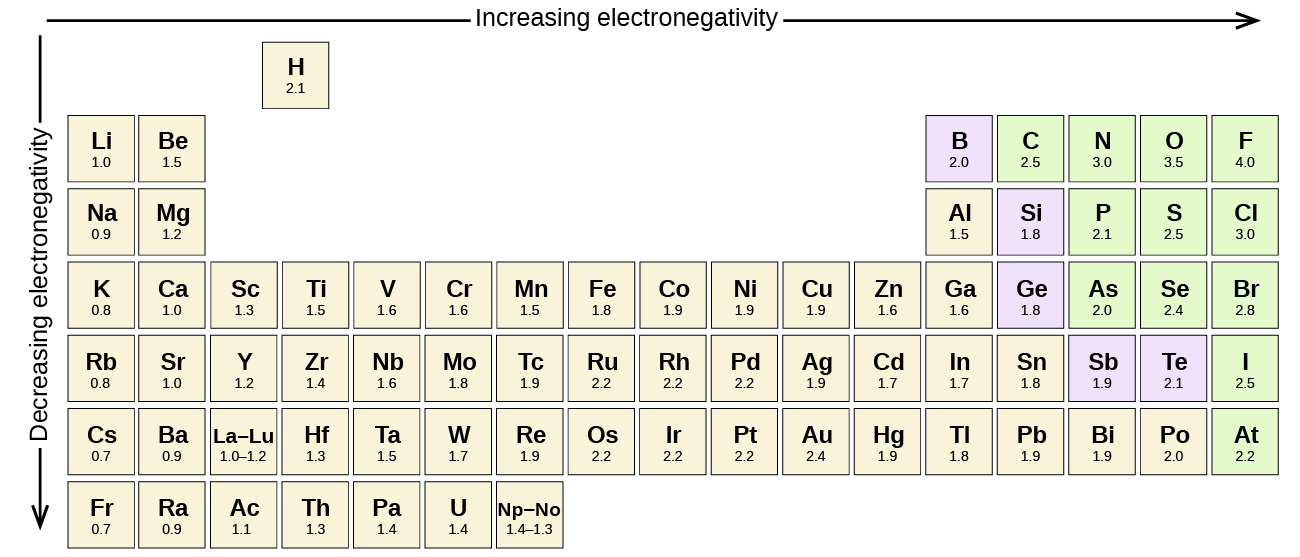
Cualquier enlace covalente entre átomos de diferentes elementos es un enlace polar, pero el grado de polaridad varía mucho. Algunos enlaces entre diferentes elementos son sólo mínimamente polares, mientras que otros son fuertemente polares. Los enlaces iónicos pueden considerarse lo último en polaridad, ya que los electrones se transfieren en lugar de compartirse. Para juzgar la polaridad relativa de un enlace covalente, los químicos utilizan la electronegatividad, que es una medida relativa de la fuerza con la que un átomo atrae electrones cuando forma un enlace covalente. Existen varias escalas numéricas para clasificar la electronegatividad. La figura \(\PageIndex{3}\Nmuestra una de las más populares: la escala de Pauling.
Mirando más de cerca: Linus Pauling
Discutiblemente el químico más influyente del siglo XX, Linus Pauling (1901-94) es la única persona que ha ganado dos premios Nobel individuales (es decir, no compartidos). En la década de 1930, Pauling utilizó nuevas teorías matemáticas para enunciar algunos principios fundamentales del enlace químico. Su libro de 1939 La naturaleza del enlace químico es uno de los más importantes que se han publicado en química.
En 1935, el interés de Pauling se centró en las moléculas biológicas, y se le concedió el Premio Nobel de Química de 1954 por su trabajo sobre la estructura de las proteínas. (Estuvo muy cerca de descubrir la estructura de doble hélice del ADN cuando James Watson y James Crick anunciaron su propio descubrimiento de su estructura en 1953). Más tarde recibió el Premio Nobel de la Paz de 1962 por sus esfuerzos para prohibir las pruebas de armas nucleares.

Linus Pauling fue uno de los químicos más influyentes del siglo XX.
En sus últimos años, Pauling se convenció de que grandes dosis de vitamina C prevendrían enfermedades, incluido el resfriado común. La mayoría de las investigaciones clínicas no mostraron una conexión, pero Pauling siguió tomando grandes dosis diarias. Murió en 1994, habiendo pasado toda su vida estableciendo un legado científico que pocos podrán igualar.
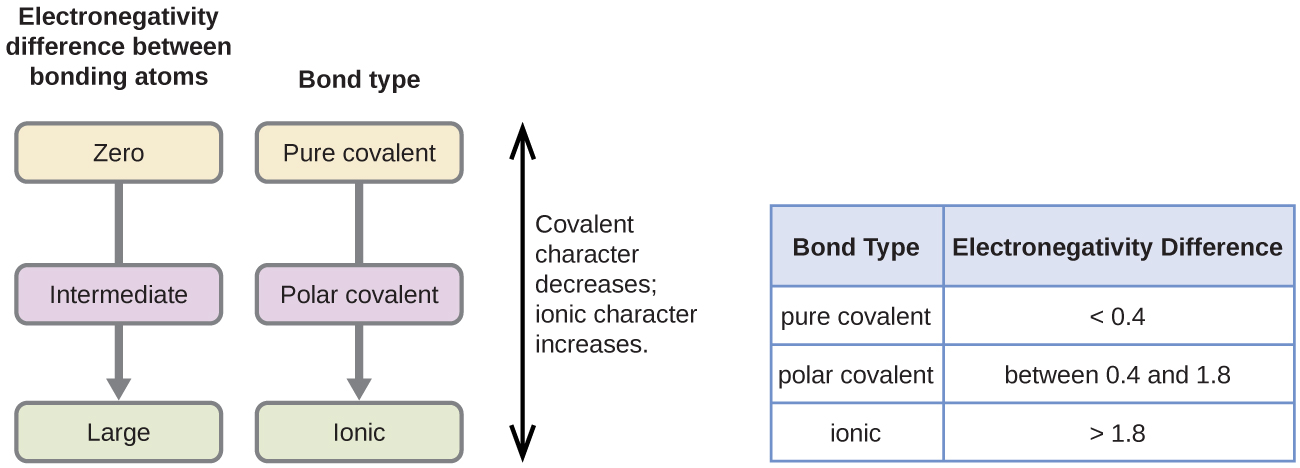
La polaridad de un enlace covalente puede juzgarse determinando la diferencia en las electronegatividades de los dos átomos que forman el enlace. Cuanto mayor sea la diferencia de electronegatividades, mayor será el desequilibrio en el reparto de electrones en el enlace. Aunque no hay reglas fijas, la regla general es que si la diferencia de electronegatividades es inferior a 0,4 aproximadamente, el enlace se considera no polar; si la diferencia es superior a 0,4, el enlace se considera polar. Si la diferencia de electronegatividades es lo suficientemente grande (generalmente superior a 1,8), el compuesto resultante se considera iónico y no covalente. Una diferencia de electronegatividad de cero, por supuesto, indica un enlace covalente no polar.
Ejemplo \(\PageIndex{1})
Describe la diferencia de electronegatividad entre cada par de átomos y la polaridad (o tipo de enlace) resultante.
- C y H
- H y H
- Na y Cl
- O y H
- El carbono tiene una electronegatividad de 2,5, mientras que el valor del hidrógeno es 2,1. La diferencia es de 0,4, que es bastante pequeña. Por tanto, el enlace C-H se considera no polar.
- Ambos átomos de hidrógeno tienen el mismo valor de electronegatividad-2,1. La diferencia es cero, por lo que el enlace es no polar.
- La electronegatividad del sodio es 0,9, mientras que la del cloro es 3,0. La diferencia es de 2,1, que es bastante alta, por lo que el sodio y el cloro forman un compuesto iónico.
- Con 2,1 para el hidrógeno y 3,5 para el oxígeno, la diferencia de electronegatividad es de 1,4. Se esperaría un enlace muy polar. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Solución
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.