Dosage Form: powder for oral suspension
Medically reviewed by Drugs.com. Last updated on April 1, 2019.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
- INDICATIONS & USAGE
- Respiratory Tract Infections
- Otitis Media
- Infecciones óseas
- Uso
- DOSIFICACIÓN & ADMINISTRACIÓN
- Pacientes adultos y pediátricos de al menos 15 años de edad
- Pacientes pediátricos (mayores de 1 año de edad)
- Ajustes de la dosis en pacientes adultos y pediátricos de al menos 15 años de edad con insuficiencia renal
- FORMAS DE DOSIFICACIÓN & ESENCIAS
- Contraindicaciones
- Advertencias y precauciones
- Reacciones de hipersensibilidad
- Diarrea asociada a Clostridium difficile
- Seroconversión de la prueba de Coombs directa
- Potencial convulsivo
- Tiempo de protrombina prolongado
- Desarrollo de bacterias resistentes a los medicamentos
- Experiencia en ensayos clínicos
- Interacciones medicamentosas
- Metformina
- Probenecid
- Interacción con pruebas de laboratorio o de diagnóstico
- Uso en poblaciones específicas
- Embarazo
- Madres lactantes
- Uso pediátrico
- Uso geriátrico
- Deterioro renal
- Sobredosis
- Descripción de la cefalexina en suspensión
- Cefalexina en suspensión – Farmacología clínica
- Mecanismo de acción
- Farmacocinética
- Microbiología
- Nonclinical Toxicology
- Carcinogenesis & Mutagenesis & Impairment Of Fertility
- How Supplied/Storage and Handling
- Información para el asesoramiento del paciente
- Etiqueta del envase.PANEL DE PRESENTACIÓN PRINCIPAL
- Frequently asked questions
- More about cephalexin
- Consumer resources
- Professional resources
- Related treatment guides
INDICATIONS & USAGE
Respiratory Tract Infections
Cephalexin is indicated for the treatment of respiratory tract infections caused by susceptible isolates of Streptococcus pneumoniae and Streptococcus pyogenes.
Otitis Media
Cephalexin is indicated for the treatment of otitis media caused by susceptible isolates of Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes, and Moraxella catarrhalis.
Infecciones de la piel y de las estructuras de la piel
Cefalexina está indicada para el tratamiento de infecciones de la piel y de las estructuras de la piel causadas por aislados susceptibles de las siguientes bacterias Gram-positivas: Staphylococcus aureus y Streptococcus pyogenes.
Infecciones óseas
Cefalexina está indicada para el tratamiento de infecciones óseas causadas por aislados susceptibles de Staphylococcus aureus y Proteus mirabilis.
Infecciones del tracto genitourinario
Cefalexina está indicada para el tratamiento de infecciones del tracto genitourinario, incluyendo la prostatitis aguda, causadas por aislados susceptibles de Escherichia coli, Proteus mirabilis y Klebsiella pneumoniae.
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de la cefalexina y de otros fármacos antibacterianos, la cefalexina debe utilizarse únicamente para tratar las infecciones que se ha demostrado o se sospecha firmemente que están causadas por bacterias susceptibles. Cuando se disponga de información sobre el cultivo y la susceptibilidad, esta información deberá tenerse en cuenta a la hora de seleccionar o modificar el tratamiento antibacteriano. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN & ADMINISTRACIÓN
Pacientes adultos y pediátricos de al menos 15 años de edad
La dosis habitual de cefalexina oral es de 250 mg cada 6 horas, pero puede administrarse una dosis de 500 mg cada 12 horas. El tratamiento se administra durante 7 a 14 días.
Para infecciones más graves pueden ser necesarias dosis mayores de cefalexina oral, hasta 4 gramos diarios en dos a cuatro dosis igualmente divididas.
Pacientes pediátricos (mayores de 1 año de edad)
La dosis diaria total recomendada de cefalexina oral para pacientes pediátricos es de 25 a 50 mg/kg administrada en dosis igualmente divididas durante 7 a 14 días. En el tratamiento de las infecciones por estreptococos β-hemolíticos, se recomienda una duración de al menos 10 días. In severe infections, a total daily dose of 50 to 100 mg/kg may be administered in equally divided doses.
For the treatment of otitis media, the recommended daily dose is 75 to 100 mg/kg given in equally divided doses.
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
Cephalexin Suspension 125mg/5mL ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. 2 to 4 tsp q.i.d. |
250mg/5mL ¼ to ½ tsp q.i.d. ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. |
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
125mg/5mL 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. 4 to 8 tsp b.i.d. |
250mg/5mL ½ to 1 tsp b.i.d 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. |
Direcciones para la mezcla
125 mg por 5 mL (100 mL cuando se mezcla): Preparar el tiempo de suspensión en la dispensación. Añadir al frasco un total de 67 mL de agua. Para facilitar la preparación, golpear la botella para aflojar el polvo, añadir el agua en 2 porciones, agitando bien después de cada adición. La suspensión resultante contendrá cefalexina monohidratada equivalente a 125 mg de cefalexina en cada 5 mL (cucharadita).
125 mg por 5 mL (200 mL al mezclar): Preparar el tiempo de suspensión en la dispensación. Añadir al frasco un total de 134 mL de agua. Para facilitar la preparación, golpear la botella para aflojar el polvo, añadir el agua en 2 porciones, agitando bien después de cada adición. La suspensión resultante contendrá cefalexina monohidratada equivalente a 125 mg de cefalexina en cada 5 mL (cucharadita).
250 mg por 5 mL (100 mL al mezclar): Preparar el tiempo de suspensión en la dispensación. Añadir al frasco un total de 67 mL de agua. Para facilitar la preparación, golpear la botella para aflojar el polvo, añadir el agua en 2 porciones, agitando bien después de cada adición. La suspensión resultante contendrá cefalexina monohidratada equivalente a 250 mg de cefalexina en cada 5 mL (cucharadita).
250 mg por 5 mL (200 mL al mezclar): Preparar el tiempo de suspensión en la dispensación. Añadir al frasco un total de 134 mL de agua. Para facilitar la preparación, golpear la botella para aflojar el polvo, añadir el agua en 2 porciones, agitando bien después de cada adición. La suspensión resultante contendrá cefalexina monohidratada equivalente a 250 mg de cefalexina en cada 5 mL (cucharadita).
*Después de mezclar, conservar en nevera. Puede conservarse durante 14 días sin pérdida significativa de potencia.
Ajustes de la dosis en pacientes adultos y pediátricos de al menos 15 años de edad con insuficiencia renal
Administrar los siguientes regímenes de dosificación de cefalexina a los pacientes con deterioro de la función renal.
Tabla 1. Recommended Dose Regimen for Patients with Renal Impairment
| Renal function | Dose regimen recommendation |
| Creatinine clearance ≥60 mL/min | No dose adjustment |
| Creatinine clearance 30 to 59 mL/min | No dose adjustment; maximum daily dose should not exceed 1 g |
| Creatinine clearance 15 to 29 mL/min | 250 mg, every 8 hours or every 12 hours |
| Creatinine clearance 5 to 14 mL/min not yet on dialysis* | 250 mg, every 24 hours |
| Creatinine clearance 1 to 4 mL/min not yet on dialysis* | 250 mg, cada 48 horas o cada 60 horas |
*No hay información suficiente para hacer recomendaciones de ajuste de dosis en pacientes en hemodiálisis.
FORMAS DE DOSIFICACIÓN & ESENCIAS
Cefalexina Para Suspensión Oral USP
125 mg/5mL y 250 mg/5mL
Contraindicaciones
.
La cefalexina está contraindicada en pacientes con hipersensibilidad conocida a la cefalexina o a otros miembros de la clase de antibacterianos cefalosporina.
Advertencias y precauciones
Reacciones de hipersensibilidad
Se han notificado reacciones alérgicas en forma de erupción cutánea, urticaria, angioedema, anafilaxia, eritema multiforme, síndrome de Stevens-Johnson o necrólisis epidérmica tóxica con el uso de cefalexina. Antes de instituir la terapia con cefalexina, pregunte si el paciente tiene un historial de reacciones de hipersensibilidad a la cefalexina, cefalosporinas, penicilinas u otros medicamentos. La hipersensibilidad cruzada entre los fármacos antibacterianos betalactámicos puede producirse hasta en un 10% de los pacientes con antecedentes de alergia a la penicilina.
Si se produce una reacción alérgica a la cefalexina, suspender el medicamento e instaurar el tratamiento adecuado.
Diarrea asociada a Clostridium difficile
Se ha notificado diarrea asociada a Clostridium difficile (DACD) con el uso de casi todos los agentes antibacterianos, incluida la cefalexina, y puede variar en gravedad desde una diarrea leve hasta una colitis mortal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que provoca un crecimiento excesivo de C. difficile.
C. difficile produce las toxinas A y B, que contribuyen al desarrollo de la DAC. Las cepas de C. difficile que producen hipertoxinas provocan un aumento de la morbilidad y la mortalidad, ya que estas infecciones pueden ser refractarias al tratamiento antimicrobiano y pueden requerir una colectomía. La CDAD debe considerarse en todos los pacientes que presentan diarrea tras el uso de antibióticos. Es necesaria una historia clínica cuidadosa, ya que se ha informado de que la DAC ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma la DAC, puede ser necesario suspender el uso continuo de antibióticos no dirigidos contra C. difficile. Debe instaurarse un manejo adecuado de líquidos y electrolitos, suplementos proteicos, tratamiento antibiótico de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
Seroconversión de la prueba de Coombs directa
Se han notificado pruebas de Coombs directas positivas durante el tratamiento con los antibacterianos de cefalosporina, incluida la cefalexina. Se ha notificado hemólisis intravascular aguda inducida por el tratamiento con cefalexina. Si se desarrolla anemia durante o después del tratamiento con cefalexina, realice una prueba diagnóstica de anemia hemolítica inducida por el fármaco, interrumpa la administración de cefalexina e instaure el tratamiento adecuado.
Potencial convulsivo
Se ha implicado a varias cefalosporinas en el desencadenamiento de convulsiones, especialmente en pacientes con insuficiencia renal cuando no se redujo la dosis. Si se producen convulsiones, suspender la cefalexina. Puede administrarse un tratamiento anticonvulsivo si está clínicamente indicado.
Tiempo de protrombina prolongado
Las cefalosporinas pueden asociarse con un tiempo de protrombina prolongado. Entre las personas de riesgo se encuentran los pacientes con insuficiencia renal o hepática, o con un mal estado nutricional, así como los pacientes que reciben un tratamiento antibacteriano prolongado y los pacientes que reciben un tratamiento anticoagulante. Controlar el tiempo de protrombina en los pacientes de riesgo y manejarlos como se indica.
Desarrollo de bacterias resistentes a los medicamentos
La prescripción de cefalexina en ausencia de una infección bacteriana probada o fuertemente sospechada es poco probable que proporcione beneficio al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
El uso prolongado de cefalexina puede dar lugar al crecimiento excesivo de organismos no susceptibles. Es esencial la observación cuidadosa del paciente. Si se produce una sobreinfección durante la terapia, deben tomarse las medidas adecuadas.
Reacciones adversas
Los siguientes acontecimientos graves se describen con mayor detalle en la sección Advertencias y precauciones:
– Reacciones de hipersensibilidad
– Diarrea asociada a Clostridium difficile
– Seroconversión de la prueba de Coombs directa
– Potencial convulsivo
– Efecto sobre la actividad de la protrombina
– Desarrollo de bacterias resistentes al medicamento
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
En los ensayos clínicos, la reacción adversa más frecuente fue la diarrea. También se han producido náuseas y vómitos, dispepsia, gastritis y dolor abdominal. Al igual que con las penicilinas y otras cefalosporinas, se han notificado hepatitis transitoria e ictericia colestática.
Otras reacciones han incluido reacciones de hipersensibilidad, prurito genital y anal, candidiasis genital, vaginitis y flujo vaginal, mareos, fatiga, dolor de cabeza, agitación, confusión, alucinaciones, artralgia, artritis y trastorno articular. Se ha notificado nefritis intersticial reversible. Se ha notificado eosinofilia, neutropenia, trombocitopenia, anemia hemolítica y ligeras elevaciones de la transaminasa de aspartato (AST) y de la transaminasa de alanina (ALT).
Además de las reacciones adversas mencionadas anteriormente que se han observado en pacientes tratados con cefalexina, se han notificado las siguientes reacciones adversas y otras pruebas de laboratorio alteradas para los medicamentos antibacterianos de la clase de las cefalosporinas:
Otras reacciones adversas: Fiebre, colitis, anemia aplástica, hemorragia, disfunción renal y nefropatía tóxica.
Pruebas de laboratorio alteradas: Tiempo de protrombina prolongado, aumento del nitrógeno ureico en sangre (BUN), aumento de la creatinina, elevación de la fosfatasa alcalina, elevación de la bilirrubina, elevación de la deshidrogenasa láctica (LDH), pancitopenia, leucopenia y agranulocitosis.
Interacciones medicamentosas
Metformina
La administración de cefalexina con metformina produce un aumento de las concentraciones plasmáticas de metformina y una disminución del aclaramiento renal de la misma.
Se recomienda una cuidadosa monitorización del paciente y un ajuste de la dosis de metformina en los pacientes que toman concomitantemente cefalexina y metformina.
Probenecid
La excreción renal de cefalexina es inhibida por probenecid. No se recomienda la coadministración de probenecid con cefalexina.
Interacción con pruebas de laboratorio o de diagnóstico
Puede producirse una reacción falsa-positiva al comprobar la presencia de glucosa en la orina utilizando la solución de Benedict o la solución de Fehling.
Uso en poblaciones específicas
Embarazo
Embarazo categoría B
No existen estudios adecuados y bien controlados en mujeres embarazadas. Dado que los estudios de reproducción en animales no siempre son predictivos de la respuesta en humanos, este medicamento debe utilizarse durante el embarazo sólo si es claramente necesario.
Se han realizado estudios de reproducción en ratones y ratas utilizando dosis orales de cefalexina monohidrato de 0.6 y 1,5 veces la dosis máxima diaria en humanos (66 mg/kg/día) en base a la superficie corporal, y no han revelado evidencia de alteración de la fertilidad o daño al feto.
Madres lactantes
La cefalexina se excreta en la leche humana. Se debe tener precaución cuando se administre cefalexina a una mujer en periodo de lactancia.
Uso pediátrico
La seguridad y eficacia de la cefalexina en pacientes pediátricos se estableció en ensayos clínicos para las dosis descritas en la sección de dosis y administración.
Uso geriátrico
De los 701 sujetos en 3 estudios clínicos publicados de cefalexina, 433 (62%) tenían 65 años o más. No se observaron diferencias globales en la seguridad o eficacia entre estos sujetos y los más jóvenes, y otra experiencia clínica comunicada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes.
Este medicamento se excreta sustancialmente por el riñón, y el riesgo de reacciones tóxicas a este medicamento puede ser mayor en pacientes con la función renal deteriorada. Debido a que los pacientes de edad avanzada son más propensos a tener una función renal disminuida, debe tenerse cuidado en la selección de la dosis.
Deterioro renal
La cefalexina debe administrarse con precaución en presencia de una función renal deteriorada (aclaramiento de creatinina < 30 mL/min, con o sin diálisis). En tales condiciones, debe realizarse una cuidadosa observación clínica y un control de la función renal mediante estudios de laboratorio, ya que la dosis segura puede ser inferior a la recomendada habitualmente.
Sobredosis
Los síntomas de sobredosis oral pueden incluir náuseas, vómitos, malestar epigástrico, diarrea y hematuria. En caso de sobredosis, instituya medidas generales de apoyo.
No se ha establecido que la diuresis forzada, la diálisis peritoneal, la hemodiálisis o la hemoperfusión de carbón sean beneficiosas para una sobredosis de cefalexina.
Descripción de la cefalexina en suspensión
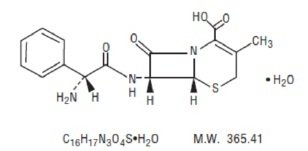
La cefalexina en suspensión oral, USP es un fármaco antibacteriano cefalosporínico semisintético destinado a la administración oral. Se trata de un ácido 7-(D-α-amino-α-fenilacetamido)-3-metil-3-cefem-4-carboxílico monohidratado. La cefalexina tiene la fórmula molecular C16H17N3O4S-H2O y el peso molecular es 365,41.
La cefalexina tiene la siguiente fórmula estructural:
Ingredientes activos: Dióxido de silicio coloidal, FD&C Rojo # 40, metilcelulosa (15 premium LV), metilcelulosa (4AC premium), benzoato de sodio, sabor a fresa, sacarosa, goma xantana.
Cefalexina en suspensión – Farmacología clínica
Mecanismo de acción
La cefalexina es un fármaco antibacteriano cefalosporínico.
Farmacocinética
Absorción:
La cefalexina es estable a los ácidos y puede administrarse sin tener en cuenta las comidas. Tras dosis de 250 mg, 500 mg y 1 g, se obtuvieron niveles séricos máximos medios de aproximadamente 9, 18 y 32 mcg/mL, respectivamente, a la hora. Los niveles séricos fueron detectables 6 horas después de la administración (a un nivel de detección de 0,2 mcg/mL).
Distribución:
La cefalexina se encuentra aproximadamente entre el 10% y el 15% unida a las proteínas plasmáticas.
Excreción:
La cefalexina se excreta en la orina por filtración glomerular y secreción tubular. Los estudios demostraron que más del 90% del fármaco se excreta sin cambios en la orina en un plazo de 8 horas. Durante este periodo, las concentraciones máximas en orina tras las dosis de 250 mg, 500 mg y 1 g fueron de aproximadamente 1.000, 2.200 y 5.000 mcg/mL respectivamente.
Interacciones con otros medicamentos:
En sujetos sanos a los que se les administró una dosis única de 500 mg de cefalexina y metformina, la Cmáx y el AUC medios de metformina en plasma aumentaron una media del 34% y 24%, respectivamente, y el aclaramiento renal medio de metformina disminuyó un 14%. No se dispone de información sobre la interacción de cefalexina y metformina tras dosis múltiples de cualquiera de los dos medicamentos.
Microbiología
Mecanismo de acción
Cefalexina es un agente bactericida que actúa mediante la inhibición de la síntesis de la pared celular bacteriana.
Resistencia
Los estafilococos resistentes a la meticilina y la mayoría de los aislados de enterococos son resistentes a cefalexina. La cefalexina no es activa contra la mayoría de los aislados de Enterobacter spp., Morganella morganii y Proteus vulgaris. La cefalexina no tiene actividad contra Pseudomonas spp. o Acinetobacter calcoaceticus. El Streptococcus pneumoniae resistente a la penicilina suele presentar resistencia cruzada a los fármacos antibacterianos betalactámicos.
Actividad antimicrobiana
La cefalexina ha demostrado ser activa frente a la mayoría de los aislados de las siguientes bacterias tanto in vitro como en infecciones clínicas .
Bacterias grampositivas
Staphylococcus aureus (sólo aislados susceptibles a la meticilina) Streptococcus pneumoniae (aislados susceptibles a la penicilina) Streptococcus pyogenes
Bacterias gramnegativasnegativas Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Para obtener información específica sobre los criterios de interpretación de las pruebas de susceptibilidad y los métodos de prueba asociados y las normas de control de calidad reconocidas por la FDA para este medicamento, por favor, consulte: https://www.fda.gov/STIC.
Nonclinical Toxicology
Carcinogenesis & Mutagenesis & Impairment Of Fertility
Lifetime studies in animals have not been performed to evaluate the carcinogenic potential of cephalexin. Tests to determine the mutagenic potential of cephalexin have not been performed. In male and female rats, fertility and reproductive performance were not affected by cephalexin oral doses up to 1.5 times the highest recommended human dose based upon body surface area.
How Supplied/Storage and Handling
Cephalexin for oral suspension* USP (a strawberry flavored formula) is supplied as follows:
125 mg/5 mL:
Bottles of 100 mL (NDC 67877-544-88)
Bottles of 200 mL (NDC 67877-544-68)
250 mg/5 mL:
Bottles of 100 mL (NDC 67877-545-88)
Bottles of 200 mL (NDC 67877-545-68)
Directions for mixing are included on the label.
Almacenar de 20o a 25o C (68o a 77o F).
Agitar bien antes de usar. Mantener bien cerrado.
*Después de mezclar, guardar en el frigorífico. Puede conservarse durante 14 días sin pérdida significativa de potencia.
Información para el asesoramiento del paciente
- Avisar a los pacientes de que pueden producirse reacciones alérgicas, incluso reacciones alérgicas graves, y que las reacciones graves requieren tratamiento inmediato. Pregunte al paciente sobre cualquier reacción de hipersensibilidad previa a la cefalexina, a otros betalactámicos (incluidas las cefalosporinas) o a otros alérgenos (5.1)
- Advierta a los pacientes que la diarrea es un problema común causado por los medicamentos antibacterianos y que normalmente se resuelve cuando se suspende el medicamento. A veces, puede producirse una diarrea acuosa o sanguinolenta frecuente y puede ser un signo de una infección intestinal más grave. Si se produce una diarrea acuosa o sanguinolenta grave, aconseje a los pacientes que se pongan en contacto con su profesional sanitario.
- Aconseje a los pacientes que los medicamentos antibacterianos, incluida la cefalexina, sólo deben utilizarse para tratar infecciones bacterianas. No sirven para tratar infecciones víricas (por ejemplo, el resfriado común). Cuando se prescriba cefalexina para tratar una infección bacteriana, diga a los pacientes que, aunque es habitual sentirse mejor al principio del tratamiento, la medicación debe tomarse exactamente como se indica. Saltarse dosis o no completar todo el tratamiento puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no puedan ser tratadas con cefalexina u otros medicamentos antibacterianos en el futuro.
- What are the best antibiotics for a tooth infection?
- Cephalexin – can this be used to treat an abscess in the mouth or gum infection?
- If people are allergic to amoxicillin can they take cephalexin?
- What is the best antibiotic to treat strep throat?
- Can you take cephalexin for a spider bite?
- Can you take antibiotics while pregnant?
- Cephalexin – is this a drug that can be abused by teens?
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Patient Tips
- Drug Images
- Drug Interactions
- Compare Alternatives
- Support Group
- Pricing & Coupons
- En Español
- 415 Reviews
- Drug class: first generation cephalosporins
- Patient Information
- Cephalexin (Advanced Reading)
- Prescribing Information
- Cephalexin (Professional Patient Advice)
- Cephalexin (FDA)
- Cephalexin Tablets (FDA)
- Bacterial Infection
- Bladder Infection
- Bacterial Endocarditis Prevention
- Acne
- … +7 more
Fabricado en la India por:
Alkem Laboratories Ltd.,
Mumbai – 400013, INDIA.
Distribuido por:
Ascend Laboratories, LLC
Parsippany, NJ 07054
Revisado: Diciembre, 2018
PT 2851
Etiqueta del envase.PANEL DE PRESENTACIÓN PRINCIPAL
NDC 67877-544-88
Cefalexina para suspensión oral, USP 125 mg por 5 mL
cuando se reconstituye según las instrucciones.
Dosis pediátrica habitual: 25 a 50 mg por kg al día en cuatro dosis divididas. En caso de infección más grave, la dosis puede duplicarse. Véase la bibliografía adjunta.
Sólo para uso oral
100 mL (cuando se mezcla)
Ascend Laboratories, LLC

NDC 67877-545-88
Cefalexina para suspensión oral, USP 250 mg por 5 mL
cuando se reconstituye según las instrucciones.
Dosis pediátrica habitual: 25 a 50 mg por kg al día en cuatro dosis divididas. En caso de infección más grave, la dosis puede duplicarse.
Véase la bibliografía adjunta.
Sólo para uso oral
100 mL (cuando se mezcla)
Laboratorios Ascend, LLC

| CEFALEXINA cefalexina para suspensión |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| CEPHALEXIN cephalexin for suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Ascend Laboratories, LLC (141250469)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Alkem Laboratories Limited | 915628612 | MANUFACTURE(67877-544, 67877-545) | |
Frequently asked questions
More about cephalexin
Consumer resources
Professional resources
Other brands Keflex, Daxbia, Panixine
Related treatment guides
Medical Disclaimer