Introducción
El enlace iónico es la transferencia completa de electrón(es) de valencia entre átomos. Es un tipo de enlace químico que genera dos iones de carga opuesta. En los enlaces iónicos, el metal pierde electrones para convertirse en un catión con carga positiva, mientras que el no metal acepta esos electrones para convertirse en un anión con carga negativa. Los enlaces iónicos requieren un donante de electrones, a menudo un metal, y un aceptor de electrones, un no metal.
El enlace iónico se observa porque los metales tienen pocos electrones en sus orbitales más externos. Al perder esos electrones, estos metales pueden alcanzar la configuración de gas noble y satisfacer la regla del octeto. Del mismo modo, los no metales que tienen cerca de 8 electrones en sus caparazones de valencia tienden a aceptar fácilmente electrones para alcanzar la configuración de gas noble. En el enlace iónico, se puede donar o recibir más de un electrón para satisfacer la regla del octeto. Las cargas del anión y del catión corresponden al número de electrones donados o recibidos. En los enlaces iónicos, la carga neta del compuesto debe ser cero.
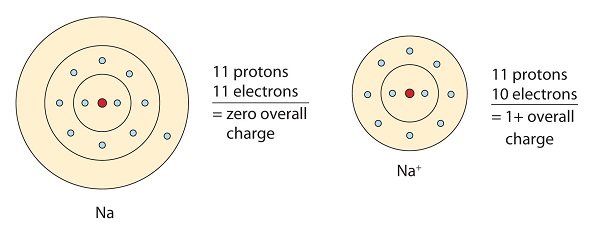
Esta molécula de sodio dona el electrón solitario en su orbital de valencia para conseguir la configuración del octeto. Esto crea un catión con carga positiva debido a la pérdida del electrón.
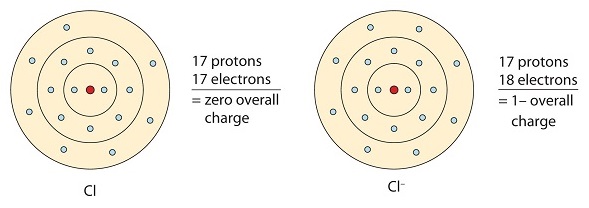
Este átomo de cloro recibe un electrón para lograr su configuración octeto, lo que crea un anión con carga negativa.
La energía global predicha del proceso de enlace iónico, que incluye la energía de ionización del metal y la afinidad electrónica del no metal, suele ser positiva, lo que indica que la reacción es endotérmica y desfavorable. Sin embargo, esta reacción es muy favorable debido a la atracción electrostática entre las partículas. En la distancia interatómica ideal, la atracción entre estas partículas libera suficiente energía para facilitar la reacción. La mayoría de los compuestos iónicos tienden a disociarse en disolventes polares porque suelen ser polares. Este fenómeno se debe a las cargas opuestas de cada ión.
Ejemplo \N(\PageIndex{1}): Sales de cloruro
.jpg?revision=2)
En este ejemplo, el átomo de sodio está donando su 1 electrón de valencia al átomo de cloro. Esto crea un catión de sodio y un anión de cloro. Observa que la carga neta del compuesto resultante es 0.
.jpg?revision=2)
En este ejemplo, el átomo de magnesio está donando sus dos electrones de valencia a los átomos de cloro. Cada átomo de cloro sólo puede aceptar 1 electrón antes de alcanzar su configuración de gas noble; por lo tanto, se requieren 2 átomos de cloro para aceptar los 2 electrones donados por el magnesio. Notice that the net charge of the compound is 0.