1. Visión general de la señalización Erk
La vía de la quinasa regulada por señales extracelulares (ERK) es uno de los principales casetes de señalización de la vía de señalización de la proteína quinasa activada por mitógenos (MAPK). La cascada ERK es activada por una variedad de agentes extracelulares, incluyendo factores de crecimiento, hormonas y también tensiones celulares para inducir procesos celulares que incluyen principalmente la proliferación y la diferenciación, pero bajo algunas condiciones también la respuesta al estrés y otros. Los principales componentes de la cinasa MAPK/ERK (MEKK) son los miembros de la familia Raf Raf-1, A-Raf y B-Raf que fosforilan dos residuos de serina en los componentes de la cinasa MAPK/ERK (MEK) MEK1/2. Las ERK1/2 se encargan de estimular los efectores descendentes, muchos de los cuales son factores de transcripción. Uno de los principales factores de transcripción es la proteína de unión al elemento de respuesta al AMP cíclico (CREB).
Esta vía ERK contribuye al control de un gran número de procesos celulares:
– Regulación de la proliferación celular como la activación de células T
– Plasticidad sináptica como la potenciación a largoplazo (LTP) en las neuronas del hipocampo
– Proliferación de las células endoteliales durante la angiogénesis
– Fosforilación del factor de transcripción p53
– La remodelación de la vía de señalización ERK puede contribuir al desarrollo de la enfermedad renal poliquística
– Activación de la fosfolipasa A2 (PLA2) en los mastocitos.
2. Cascada de señalización Erk
La activación de la cascada ERK1/2 se inicia mayoritariamente en los receptores de membrana, como los receptores Tyr quinasas (RTKs), los receptores acoplados a proteínas G (GPCRs), los canales iónicos y otros. Estos receptores transmiten la señal reclutando proteínas adaptadoras (por ejemplo, Grb2) y factores de intercambio (por ejemplo, SOS) que, a su vez, inducen la activación de Ras en las membranas plasmáticas, o en las membranas de otros orgánulos. El Ras activado, unido a GTP, transmite entonces la señal mediante la activación de las proteínas quinasas Raf-1, B-Raf y A-Raf (Rafs) dentro del nivel MAP3K de esta cascada. Esta activación se produce mediante el reclutamiento de Rafs a las membranas, donde se fosforilan y activan. La MOS es otra MAP3K de la cascada ERK, pero opera principalmente en el sistema reproductivo mediante un modo de regulación distinto. Desde el nivel de la MAP3K, la señal se transmite luego hacia abajo en la cascada a través de los componentes de la MAPKK: MEK1/2. Se activan a través de la fosforilación de serina en el motivo Ser-Xaa-Ala-Xaa-Ser/Thr típico de las MAPKK en su bucle de activación. A su vez, las MEK1/2 activan sus únicos sustratos conocidos, las ERK1/2 nativas, que funcionan como sus únicas dianas aguas abajo, lo que sugiere que las MEK1/2 sirven como componentes determinantes de la especificidad de la cascada ERK1/2. Las MEK1/2 son las únicas proteínas quinasas de doble especificidad que pueden fosforilar tanto los residuos reguladores Thr como Tyr de ERK1/2. Hasta la fecha se han identificado unos 200 sustratos distintos de ERK1/2. Son sustratos bien en el citosol (por ejemplo, PLA2 RSK), o bien, tras su translocación, en el núcleo, incluyendo factores de transcripción como Elk1, c-Fos y c-Jun.
– MAP3K-Raf 1
Raf-1 es la mejor estudiada de las moléculas de señalización del factor de crecimiento en el nivel MAP3K de la cascada. Es una proteína serina/treonina quinasa de 70 a 75 kDa, que contiene un dominio quinasa en la mitad COOH-terminal de la molécula y un dominio regulador que ocupa el resto. Tras la estimulación con varios mitógenos, Raf-1 sufre una activación transitoria en 2-3 mm. El mecanismo de activación de Raf-1 se ha estudiado ampliamente en los últimos años. Ahora está claro que Raf-1 se localiza aguas abajo de HAS, que parece interactuar directamente con la porción terminal NH2 de Raf-1 en la estimulación.
– MAPKK-MEK1/2
Las MEKs constituyen una familia evolutivamente conservada de proteínas serina/treonina quinasas que hasta la fecha incluye tres isoformas mamíferas altamente homólogas (85%). El mecanismo de activación de MEK-1 implica la fosforilación de la proteína en residuos de serina únicamente y parece ser similar tanto si es fosforilada por MEKK, como por Raf-1 o por autofosforilación, tal y como se ha determinado mediante mapas de fosfopéptidos. Las MAPKK (MEK) son altamente específicas para los componentes descendentes ERK-1 y ERK-2. Además, las MAPKK no reconocen ni la forma desnaturalizada de su sustrato ni los péptidos que contienen los sitios de fosforilación en ERK, lo que indica que la enzima requiere la forma nativa de MAPK.
– MAPK-ERK-1/2
Debido a su alto grado de similitud, se suele considerar que ERK-1 y ERK-2 son funcionalmente redundantes. El principal mecanismo ascendente que conduce a la fosforilación de ERK-1 y -2 en ambos residuos reguladores es su fosforilación por MEK. Debido a la naturaleza bastante amplia de su reconocimiento de sustratos, las ERK pueden fosforilar un gran número de proteínas tras su activación. Estas proteínas suelen ser de naturaleza reguladora y se localizan tanto en el citoplasma como en el núcleo.
3. Señalización descendente de la vía Erk
– Proliferación celular
La ERK1/2 activada fosforila a la RSK y tanto ésta como la ERK se translocan al núcleo, donde activan múltiples factores de transcripción como CREB, Fos y Elk-1, dando lugar en última instancia a la síntesis de proteínas efectoras y provocando cambios en la proliferación y supervivencia celular. CREB (cAMP response element-binding protein) es un factor de transcripción celular que puede potenciar la transcripción de genes por encima de 10 veces. c-fos es una proteína de 380 aminoácidos con una región básica de cremallera de leucina para la dimerización y la unión al ADN y un dominio de transactivación en el extremo C. Está implicada en importantes acontecimientos celulares, como la proliferación, la diferenciación y la supervivencia de las células; la proteína que contiene el dominio ETS (Elk-1) es una proteína que en los seres humanos está codificada por el gen ELK1. Elk-1 funciona también como activador de la transcripción.
– Oncogénesis
La activación de ERK1/2 promueve la metaplasia y el desarrollo tumoral al fosforilar Bim y Bid y provocar la degradación del proteasoma de Bim y el secuestro de Bad en las proteínas de unión a fosfoserina y, por tanto, inhibir la apoptosis. En una vía distinta, la activación de ERK1/2 fosforila FOXO3a en Ser 294, Ser 344 y Ser 425 y facilita la interacción FOXO3a-MDM2. Esta interacción potencia la degradación de FOXO3a a través de una vía ubiquitina-proteasoma dependiente de MDM2, lo que conduce al desarrollo de tumores.
– Desarrollo y diferenciación
La señalización por parte de receptores tirosina quinasas que activan la vía Ras/Raf/MAP quinasa regula el desarrollo y la diferenciación de muchos tipos de células. Principalmente a través de la activación de las proteínas transductoras de señales y activadoras de la transcripción (STATs).
– Ciclo celular
Cdc25 activa las cinasas dependientes de ciclinas eliminando el fosfato de los residuos en el sitio activo de la Cdk. Se sabe que controla las transiciones de la fase G1 a la S y de la fase G2 a la M. Erk1/2 puede activar la proteína Cdc25 y a su vez promover la progresión del ciclo celular.
4. Regulación de la señalización de Erk
La regulación de la señalización de Erk es muy importante para que podamos mantener la función normal de las células. Existen múltiples estrategias de regulación para que la célula regule la vía de señalización de Erk, principalmente incluyen la regulación por bucles de retroalimentación, por andamios ascendentes y descendentes, por fosfatasas e inhibidores de la vía de señalización de Erk.
– Regulación por bucles de retroalimentación
Hay varios puntos de retroalimentación negativa en la vía de ERK (Figura 1). MEK es una de las dianas y puede ser inhibida por ERK fosforilando MEK1/2 en Thr292 y Thr212. La fosforilación impide el aumento de la actividad de MEK por PAK1 y, por tanto, reduce la activación de ERK. La fosforilación de Raf en múltiples sitios por ERK proporciona un segundo posible mecanismo de bucle de retroalimentación. La hiperfosforilación de estos sitios impide la interacción de Raf con la GTPasa Ras y promueve su desfosforilación por la fosfatasa PP2A. La activación o regulación transcripcional de las fosfatasas por ERK es un mecanismo alternativo de retroalimentación negativa. Estos diversos bucles de retroalimentación negativa activados por ERK proporcionan un medio para limitar la duración de la señal y devolver la vía al estado basal.
– Regulación de andamios ascendentes y descendentes
Las proteínas de andamiaje se unen a dos o más componentes de una vía de señalización para acercarlos y facilitar así su interacción funcional. Además, los andamios pueden dirigir estos módulos de señalización multienzimática a diferentes localizaciones celulares y, por lo tanto, potenciar la fosforilación de un subconjunto específico de sustratos descendentes. Los andamios también afectan a la duración de la señal, evitan la diafonía entre vías similares y pueden vincular la activación del módulo de señalización a una señal activadora específica aguas arriba.
– Fosfatasas e inhibidores
La actividad de las vías MAPK está determinada por las acciones competitivas de las quinasas aguas arriba y las fosfatasas inhibidoras. Las vías MAPK terminan con la desfosforilación de sus componentes por parte de varias fosfatasas. Se ha demostrado que varias fosfatasas de serina/treonina, como PP2A y PP2Ca, y fosfatasas de tirosina, como PTP-SL y HePTP, inactivan las MAPKs.
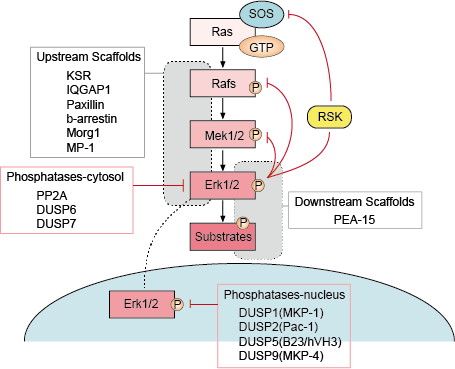
Figura 1. Regulación de la vía de señalización de Erk
5. Relación con las enfermedades
En consonancia con sus funciones críticas en actividades celulares clave, incluyendo la proliferación, la diferenciación y la supervivencia o la muerte de las células, las vías de señalización MAPK han sido implicadas en la patogénesis de muchas enfermedades humanas.
– Enfermedad de Alzheimer
La enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa caracterizada por la disfunción cognitiva y de la memoria que se cree que es el resultado de la formación en el cerebro tanto de placas seniles que contienen amiloide-β (Aβ) como de ovillos neurofibrilares que contienen la proteína tau asociada a los microtúbulos. La evidencia sugiere, por tanto, que las vías de señalización MAPK pueden contribuir a la patogénesis de la EA a través de la regulación de la apoptosis neuronal, la actividad β- y γ-secretasa, y la fosforilación de APP y tau.
– Enfermedad de Parkinson
– La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa más prevalente. Diversas observaciones sugieren que las vías de señalización de MAPK contribuyen a las respuestas neuroinflamatorias y a la muerte neuronal desencadenada por los agregados de α-sinucleína o las deficiencias funcionales de parkina o DJ-1 en la patogénesis de la enfermedad de Parkinson.
– Señalización de MAPK en el cáncer
Muchas de las mutaciones asociadas al cáncer de los componentes de las vías de señalización de MAPK se han encontrado en Ras y B-Raf, que participan en la vía de señalización de ERK. La vía de señalización ERK desempeña un papel en varios pasos del desarrollo tumoral. La fosforilación por ERK de proteínas como la quinasa de cadena ligera de miosina, la calpaína, la quinasa de adhesión focal y la paxilina promueve la migración de las células cancerosas. Además, la señalización de ERK1/2 regula las actividades y los niveles de las proteínas de la familia Bcl-2, como la proteína proapoptótica BIM y la proteína antiapoptótica MCL-1, promoviendo así la supervivencia de las células cancerosas.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |