


Tabla de contenidos
Fisiopatología del SOP
Criterios de diagnóstico
Resistencia a la insulina y resistencia a la leptina
Autores
Muchos de nosotros no nos damos cuenta de lo bien que funciona el intrincado sistema de bucles de retroalimentación de nuestro sistema endocrino reproductivo hasta que se altera de alguna manera. El síndrome de ovario poliquístico (SOP) es un ejemplo de ello. Es un trastorno caracterizado por un conjunto de síntomas, y es frecuente en las pacientes que acuden a las clínicas de infertilidad, afectando al 5-10% de las mujeres en edad reproductiva. Se estima que el 90% de los casos anovulatorios están relacionados con el SOP. Además de afectar negativamente a los parámetros metabólicos y a la ovulación, también se asocia a varios problemas de salud mental (como la depresión y la ansiedad) en las mujeres que lo padecen. En la parte 1, hablaremos de la fisiopatología del SOP, sus criterios de diagnóstico y la resistencia a la insulina y la leptina. En la parte 2, abordaremos el manejo del SOP, las implicaciones psicológicas y el papel único del clínico en el apoyo a la paciente con SOP.
Patofisiología del SOP
En las mujeres ovulatorias, bajo la influencia de un eje hipotálamo-hipofisario-ovárico (HPO) que funciona correctamente, el ciclo menstrual se caracteriza por el crecimiento y desarrollo de (normalmente) un único folículo que se extrae de la cohorte (grupo de folículos) de ese mes. En respuesta a la estimulación de la GnRH, la hipófisis anterior segrega dos importantes gonadotropinas: La hormona foliculoestimulante (FSH) y la hormona luteinizante (LH). La FSH actúa sobre el ovario para ayudar a que crezcan y maduren los folículos pequeños. El folículo dominante de ese mes es el que ha adquirido más receptores de FSH. Este folículo continuará creciendo y madurando a expensas de los restantes folículos pequeños, que luego son reabsorbidos por el cuerpo (pero aún se deducen del suministro total de óvulos de la mujer). El crecimiento del folículo dominante genera la producción de estradiol y los niveles elevados de estrógeno señalan el cese de la producción de FSH a través de un sistema de retroalimentación negativa, pero un nivel alto y sostenido de estrógeno desencadenará una oleada única de LH que provoca la ovulación.
En una mujer con SOP el eje HPO no expresa una funcionalidad normal. La hormona pulsátil GnRH está alterada, lo que provoca un aumento de la actividad de la LH por parte de la hipófisis. Este aumento de la LH incrementa la estimulación de la célula theca (ver Fig. 1), que produce androstenediona y testosterona, dos andrógenos, y el entorno hiperandrogénico resultante del ovario impide el crecimiento folicular normal, la maduración y la ovulación. El ovario, por lo tanto, se compone de muchos folículos pequeños y antrales que nunca llegan a ser dominantes. La acumulación de estos folículos puede provocar un aumento del tamaño de los ovarios y generar un nivel sérico de estrógenos ligeramente elevado. Todavía se desconoce por qué se produce el SOP y a quién afecta, pero se cree que la genética y los factores ambientales tienen una compleja interacción en su aparición y en sus manifestaciones clínicas.
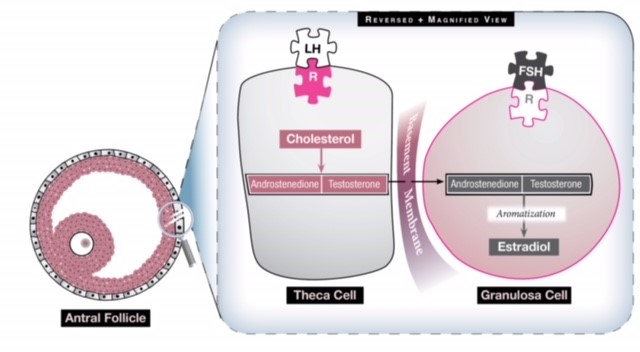
Fig 1: En el ovario hay dos células que contribuyen a la producción de estrógenos y que trabajan en sinergia. La célula theca convierte el colesterol en dos andrógenos (androstenediona y testosterona) bajo la influencia de la LH. A continuación, estos andrógenos viajan a través de la membrana basal hasta la célula de la granulosa que, bajo la influencia de la FSH, los convierte en estrógenos mediante un proceso denominado aromatización. El exceso de estimulación de LH, entonces, generará más andrógenos de los que pueden ser convertidos en estrógenos, por lo que el nivel de estrógenos nunca llega a ser lo suficientemente elevado como para generar una oleada de LH y el ovario tiene un medio hiperandrogénico.
Criterios de diagnóstico
El síndrome de ovario poliquístico no se define ni se diagnostica por un simple síntoma y suele ser un diagnóstico de exclusión para las mujeres que tienen oligo-ovulación y evidencias de hiperandrogenismo (como acné, alopecia e hirsutismo) una vez que se excluyen otros trastornos. Afecta a mujeres de todas las formas, tamaños y orígenes. Aunque los síntomas pueden comenzar en la menarquia, la mayoría de los médicos son reacios a diagnosticar el SOP a una adolescente que acaba de menstruar, ya que la irregularidad del ciclo menstrual es normal en el primer año después de la menarquia y puede resolverse con el tiempo. Los criterios de diagnóstico más utilizados en la actualidad fueron revisados en un taller internacional de expertos celebrado en Rotterdam (Países Bajos) en 2003 y se denominan «Criterios de Rotterdam»: El SOP sólo puede diagnosticarse cuando una paciente presenta al menos dos de las tres características siguientes: oligo/anovulación, hiperandrogenismo (bioquímico o clínico) y la aparición de ovarios poliquísticos en la ecografía.El hiperandrogenismo se diagnostica clínicamente (por la observación de los síntomas androgénicos por parte del clínico) o bioquímicamente (como niveles elevados de testosterona libre en suero).
Estos criterios fueron revisados en 2018 por un comité internacional que realizó algunos cambios. En primer lugar, debido a la disponibilidad de ecógrafos transvaginales sensibles, la morfología ovárica poliquística (PCOM) se caracteriza por la presencia de 20 o más folículos (<10 mm) en cualquiera de los ovarios o un volumen ovárico ≥ 10 mlon cualquiera de los ovarios visto por ecografía transvaginal, a menudo situado alrededor de la periferia del ovario (u ovarios). Las directrices de 2018 también establecen que si una mujer tiene ciclos menstruales irregulares e hiperandrogenismo que el ultrasonido no es necesario para el diagnóstico, aunque muchos clínicos todavía prefieren realizarlo. Los niveles de la hormona antimulleriana (AMH) suelen estar elevados en las pacientes con SOP, aunque esto no es específico del SOP, ya que se pueden encontrar niveles elevados en mujeres sin esta enfermedad. En las mujeres afectadas por el SOP, un nivel elevado de AMH refleja un mayor número de folículos detenidos en las fases preantral y antral que no llegan a ovular.
Primero hay que descartar otras condiciones que pueden causar ciclos menstruales irregulares (embarazo, hipo e hipertiroidismo, insuficiencia ovárica e hiperprolactinemia) e hiperandrogenismo (hiperplasia suprarrenal congénita, tumor suprarrenal y tumor secretor de andrógenos), por lo que, además de los niveles séricos de bHCG, se extraen los niveles basales de FSH yLH, la hormona tiroestimulante (TSH), la prolactina, la testosterona total y libre, la 17hidroxiprogesterona (17OHP) y el sulfato de deshidroepiandrosterona (DHEAS). Uno de los diagnósticos diferenciales más difíciles es discernir entre una mujer con amenorrea hipotalámica funcional (FHA) y una mujer delgada con SOP. Clásicamente, las mujeres con FHA tienen un IMC bajo, pero también puede estar en el rango bajo/normal. Ambas condiciones se caracterizan por anovulación y ovarios que parecen tener muchos folículos pequeños en estado de reposo. Aunque el hiperandrogenismo no es un componente de la FHA, las mujeres que la padecen pueden tener hirsutismo debido a su origen étnico, lo que confunde aún más el cuadro clínico. Una forma de distinguir la FHA del síndrome de ovario poliquístico es mediante un análisis de sangre y una ecografía. Las mujeres con FHA suelen tener niveles basales de FSH y LH de bajos a normales (debido a la hipoestimulación de los ovarios) y un nivel bajo de estrógenos, mientras que las mujeres con SOP suelen tener niveles elevados de LH en suero y niveles de FSH de bajos a normales. En la ecografía, el útero y los ovarios de las mujeres con FHA son pequeños o pequeños/normales, mientras que las mujeres con SOP suelen tener un volumen ovárico aumentado (>10 ml).
Resistencia a la insulina y resistencia a la leptina
Aunque el diagnóstico de resistencia a la insulina (IR) no forma parte de los Criterios de Rotterdam, es muy frecuente en las mujeres con SOP. Un IMC elevado aumenta la probabilidad de que una mujer con SOP tenga IR, pero incluso las mujeres no obesas con SOP tienen muchas más probabilidades de desarrollar resistencia a la insulina que sus homólogas de tamaño similar sin SOP. Además de las consecuencias para la salud de la IR (como el síndrome metabólico y la diabetes mellitus de tipo 2), también exacerba y contribuye al hiperandrogenismo en una población de pacientes que ya lo padecen.
El estándar de oro para diagnosticar la resistencia a la insulina es utilizar una pinza euglucémica hiperinsulinémica, prueba que debe realizarse en un entorno hospitalario. Para la mayoría, esto no es razonable, por lo que se realizan pruebas indirectas para la IR. En las mujeres con SOP en el entorno clínico de la preconcepción, se sugiere realizar una prueba de tolerancia a la glucosa oral (PTGO), dado el alto riesgo de las mujeres con SOP de desarrollar intolerancia a la glucosa y diabetes gestacional durante el embarazo. Aunque consume algo de tiempo, esta prueba es preferible a la glucosa plasmática en ayunas y a los niveles de insulina por sí solos, ya que puede diagnosticar la alteración de la tolerancia a la glucosa en una fase más temprana.En las mujeres con SOP que no están en una categoría de alto riesgo (es decir, IMC<25 kg/m2, que no estén intentando concebir, que no tengan antecedentes personales o familiares de intolerancia a la glucosa) obtener al menos los niveles de glucosa, insulina y hemoglobinaA1c en ayunas puede ser útil para obtener una «instantánea» del estado glucémico de la paciente.
Cuando una mujer tiene SOP, el sobrepeso o la obesidad intensifican las consecuencias metabólicas. Los glóbulos blancos son metabólicamente activos. En un nivel normal, son protectoras, ya que proporcionan un hogar seguro para los lípidos y mantienen la grasa fuera de los órganos. Cuando hay demasiadas células grasas, pueden sobrecargarse y estallar, liberando ácidos grasos en el torrente sanguíneo que pueden afectar a todos los órganos. Estas células grasas se quedan «atascadas» entre las células de los órganos y hacen que éstos estén rígidos, dañados, sean menos funcionales y provoquen una inflamación crónica. No es infrecuente diagnosticar un «hígado graso» en una mujer obesa con SOP, ya que el hígado es especialmente vulnerable. Además, un exceso de adiposidad puede perpetuar la hiperinsulinemia y la resistencia a la insulina existentes al alterar el delicado equilibrio de citoquinas y hormonas producidas por el tejido adiposo (véase la figura 2), por ejemplo, disminuyendo la producción de citoquinas que aumentan la sensibilidad a la insulina y aumentando las que promueven la inflamación y la resistencia a la insulina. El exceso de insulina contribuye además a la adiposidad abdominal y al hiperandrogenismo creando un círculo vicioso en las pacientes con SOP que puede ser difícil de superar.
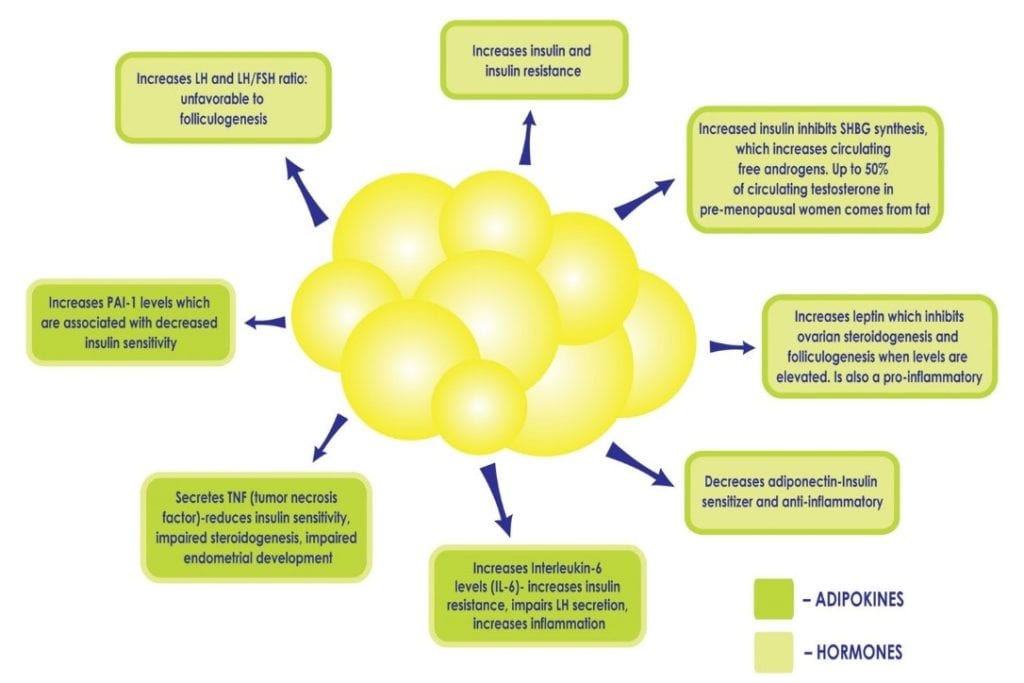
Figura 2: El aumento de la adiposidad, y el consiguiente incremento de las células grasas, puede perpetuar la hiperinsulinemia y la resistencia a la insulina al alterar el delicado equilibrio de las hormonas producidas por el tejido adiposo, como la disminución de la producción de adiponectina, una citoquina que aumenta la sensibilidad a la insulina y el aumento de otras que promueven la inflamación.
Además de la resistencia a la insulina, los pacientes con SOP y obesidad también pueden sufrir lo que algunos denominan resistencia a la leptina. Algunos estudios han demostrado que los niveles de leptina son más altos en las pacientes obesas con SOP en comparación con las pacientes delgadas. La leptina es una proteína producida por el tejido adiposo que regula el equilibrio energético del cuerpo y el apetito. Cuando funciona correctamente, un aumento de la leptina indica al cerebro que reduzca el apetito de una persona y una disminución de la leptina hace lo contrario, indica al cerebro que aumente el apetito para proporcionar el combustible necesario para la energía. Sin embargo, en muchas pacientes de SOP con obesidad, este sistema es defectuoso y, a pesar del aumento de las concentraciones de leptina secundario al aumento del tejido adiposo, la eficacia de la leptina disminuye, dando lugar a la resistencia a la leptina. La resistencia a la leptina se considera un importante factor de riesgo para la patogénesis del sobrepeso y la obesidad, ya que el organismo permanece insensible a los niveles elevados y señala a la mujer que sigue teniendo hambre/no está saciada incluso después de comer. Muchas mujeres con SOP se quejan de que «nunca se sienten llenas» debido a esta resistencia y siguen comiendo, lo que conduce a un aumento del tejido adiposo, que provoca una mayor resistencia a la leptina y perpetúa este ciclo perjudicial. Como resultado, las condiciones de sobrepeso y obesidad son comunes en las mujeres con SOP y la pérdida de peso puede parecer imposible ya que la alimentación intuitiva no es eficaz cuando las señales de hambre y saciedad no son fiables.
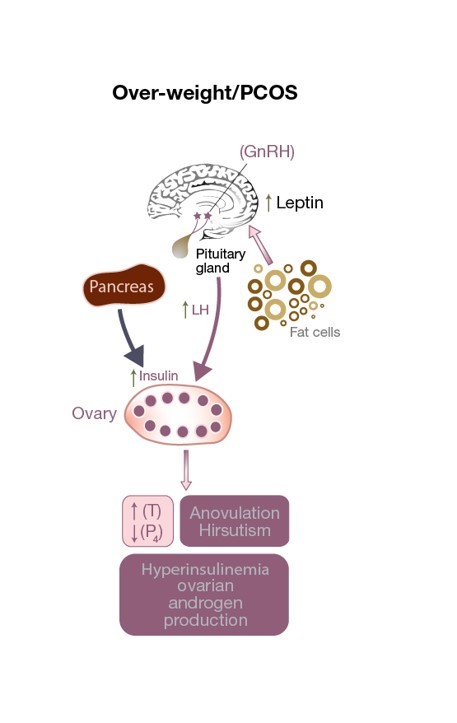
Figura 3: Alteración del eje HPO en una paciente con SOP. Hay un exceso de estimulación de la LH en la célula theca que resulta en un aumento de los niveles de testosterona, un entorno ovárico androgénico y anovulación (que resulta en niveles bajos de progesterona). El aumento de los niveles de leptina debido a un exceso de células adiposas afecta a la secreción de GnRH. Los niveles elevados de insulina contribuyen al hiperandrogenismo.
La secreción alterada de leptina no sólo afecta al peso corporal, sino que puede tener un efecto perjudicial sobre la ovulación (ver Fig. 3) e incluso sobre la fertilización en pacientes con SOP de peso normal. Altera la liberación de GnRH del hipotálamo, disminuyendo la estimulación de la hipófisis anterior (y por tanto la secreción de FSH y LH), e impidiendo el desarrollo de un ovocito maduro. Además, las células de la granulosa también almacenan y producen leptina, y los niveles elevados de leptina disminuyen su capacidad de aromatización, lo que en última instancia interfiere en la capacidad de un folículo dominante para producir cantidades adecuadas de estrógeno (véase la figura 1). Un pequeño estudio observacional encontró una correlación directa entre la concentración de leptina encontrada en el fluido folicular (FF-leptina) (que se ha correlacionado con la tasa de fertilización) en mujeres delgadas con SOP que se han sometido a FIV cuando se comparan con mujeres de peso normal.
Autores
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Un agradecimiento especial a NeilChappell, MD por su ayuda en la edición de este artículo.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter »



![]()