Charges formelles
Les molécules organiques peuvent également être associées à des charges positives ou négatives. Au cours des réactions chimiques, il est courant d’avoir des réactifs, des intermédiaires et/ou des produits chargés. Reconnaître et distinguer les modèles de liaison neutres et chargés sera utile pour apprendre les mécanismes de réaction. Prenons l’exemple de la structure de Lewis du méthanol, CH3OH (le méthanol est ce que l’on appelle « l’alcool de bois » que des bootleggers sans scrupules vendaient parfois à l’époque de la prohibition, dans les années 1920, et qui rendait souvent aveugles les personnes qui le buvaient). Le méthanol lui-même est une molécule neutre, mais il peut perdre un proton pour devenir un anion moléculaire (CH3O-), ou gagner un proton pour devenir un cation moléculaire (CH3OH2+).

L’anion et le cation moléculaires ont des charges globales de -1 et +1, respectivement. Mais nous pouvons être plus précis que cela – nous pouvons également affirmer pour chaque ion moléculaire qu’une charge formelle est située spécifiquement sur l’atome d’oxygène, plutôt que sur l’atome de carbone ou l’un des atomes d’hydrogène.
Déterminer la charge formelle sur les différents atomes d’une molécule est un processus simple – il s’agit simplement d’additionner les électrons de valence.
Un atome d’oxygène non lié possède 6 électrons de valence. Cependant, lorsqu’il est lié en tant que partie d’une molécule de méthanol, un atome d’oxygène est entouré de 8 électrons de valence : 4 électrons non liants (deux » paires solitaires « ) et 2 électrons dans chacune de ses deux liaisons covalentes (une au carbone, une à l’hydrogène). Dans la convention de charge formelle, nous disons que l’oxygène « possède » les 4 électrons non liés. Cependant, il ne « possède » qu’un seul électron de chacune des deux liaisons covalentes, car les liaisons covalentes impliquent le partage des électrons entre les atomes. Par conséquent, l’atome d’oxygène du méthanol possède 2 + 2 + (½ x 4) = 6 électrons de valence.
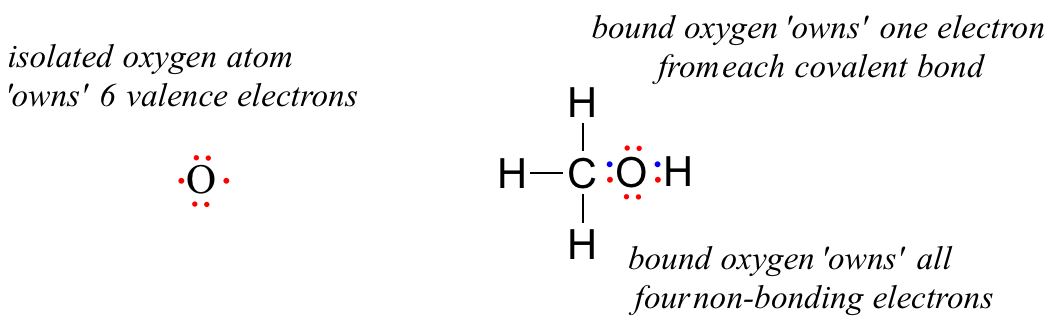
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
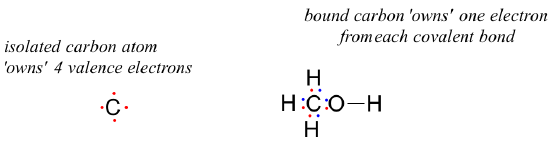
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
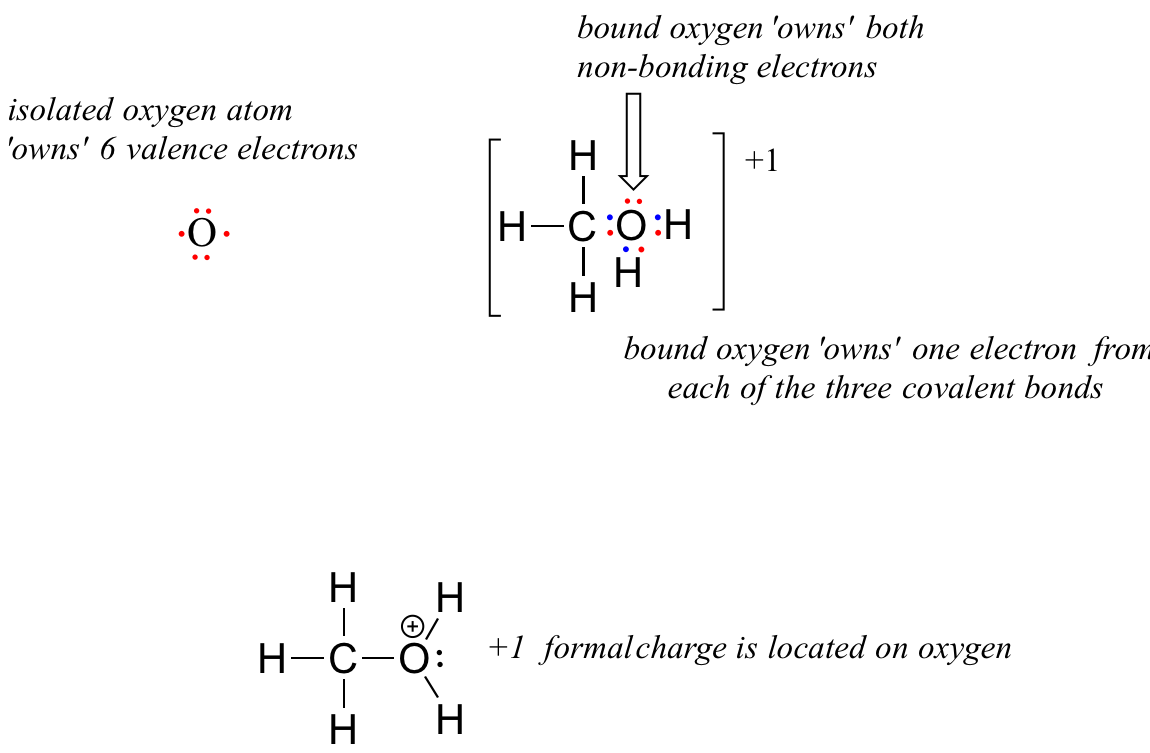
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
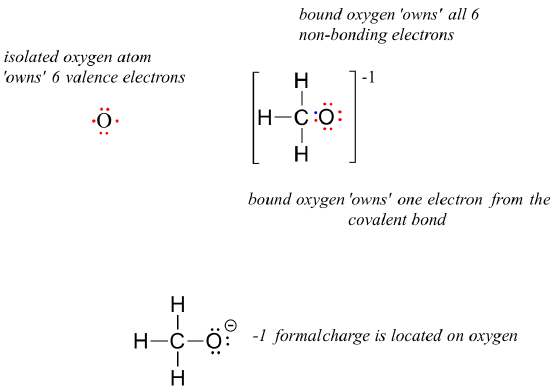
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Lorsque vous dessinez les structures des molécules organiques, il est très important de montrer toutes les charges formelles non nulles, en étant clair sur l’emplacement des charges. Une structure à laquelle il manque des charges formelles non nulles n’est pas correctement dessinée, et sera probablement notée comme telle lors d’un examen !
À ce stade, en repensant à ce que vous avez appris en chimie générale, vous vous demandez probablement : » Qu’en est-il des dipôles ? Un atome d’oxygène dans une liaison O-H ne » possède « -t-il pas plus de densité électronique que l’hydrogène, en raison de sa plus grande électronégativité ? » C’est tout à fait exact, et nous passerons en revue le concept de dipôles de liaison un peu plus loin. Pour le calcul des charges formelles, cependant, les dipôles de liaison n’ont pas d’importance – nous considérons toujours que les deux électrons d’une liaison sont partagés de manière égale, même si cela ne reflète pas exactement la réalité chimique. Les charges formelles ne sont qu’une formalité, une méthode de comptabilité des électrons liée au système de Lewis pour dessiner les structures des composés organiques et des ions. Plus tard, nous verrons comment le concept de charge formelle peut nous aider à visualiser la réaction des molécules organiques.
Enfin, ne vous laissez pas entraîner à penser que ce n’est pas parce que la charge nette d’une structure est nulle qu’il n’y a pas d’atomes ayant des charges formelles : un atome pourrait avoir une charge formelle positive et un autre une charge formelle négative, et la charge nette serait toujours nulle. Les zwitterions, comme les acides aminés, ont des charges formelles positives et négatives sur différents atomes :

Même si la charge nette sur la glycine est nulle, il est quand même nécessaire de montrer l’emplacement des charges formelles positives et négatives.
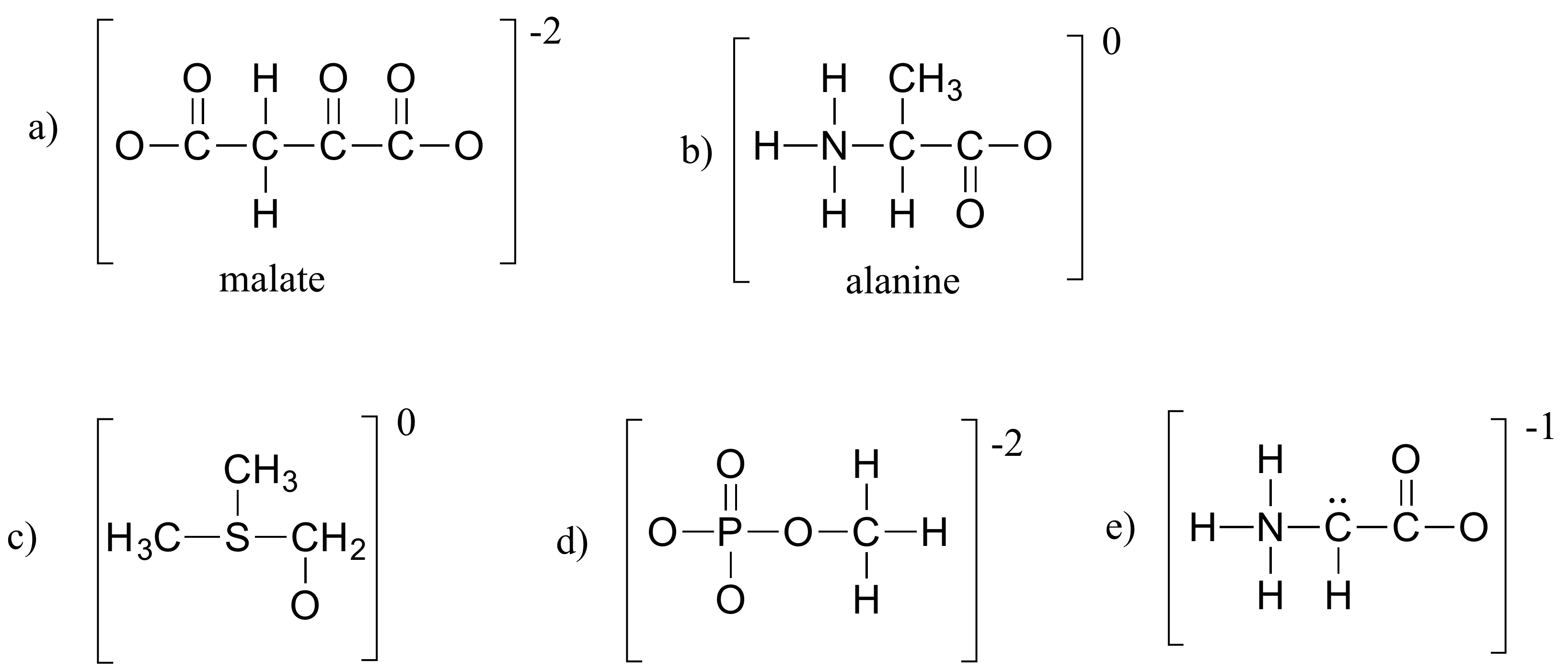
Exercice 1.4
Remplir tous les électrons solitaires et les charges formelles manquants dans les structures ci-dessous. Supposez que tous les atomes ont une coquille de valence complète d’électrons. Les charges nettes sont indiquées à l’extérieur des parenthèses.
Solutions des exercices
.