Théorie MO et liaisons pi conjuguées
L’avantage d’utiliser la théorie MO pour comprendre les liaisons dans les molécules organiques devient plus évident lorsque nous pensons aux liaisons pi. Considérons d’abord la liaison pi dans l’éthène du point de vue de la théorie MO (dans cet exemple, nous ne tiendrons pas compte des liaisons s dans la molécule, et nous ne penserons qu’à la liaison π). Nous commençons avec deux orbitales atomiques : une orbitale 2p non hybridée de chaque carbone. Chacune contient un électron unique. Dans la théorie MO, les deux orbitales atomiques se combinent mathématiquement pour former deux orbitales moléculaires pi, une orbitale pi de liaison de faible énergie et une orbitale pi* d’anti liaison de haute énergie.
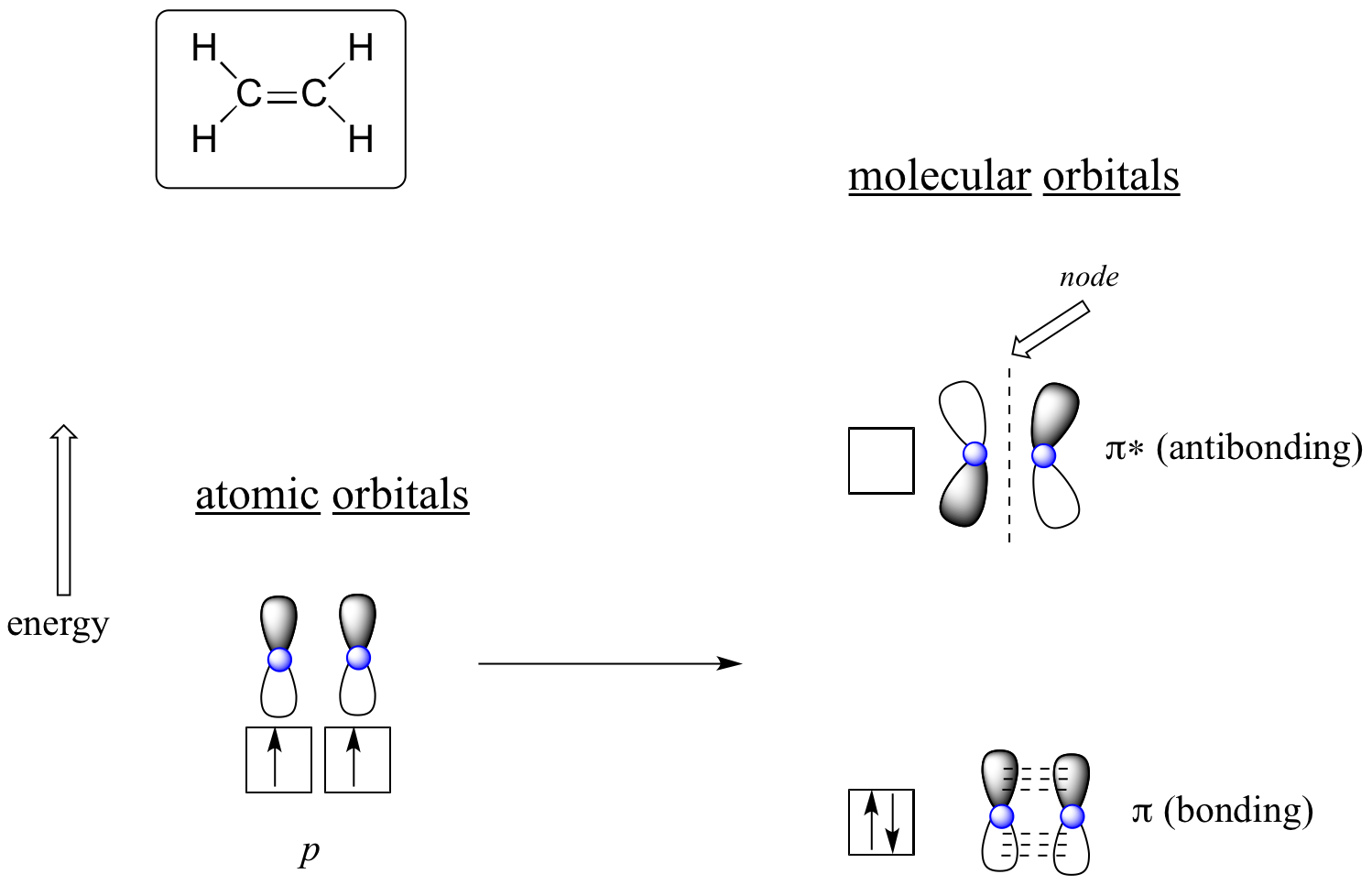
Orbitales moléculaires de l’éthène (éthylène)
Dans l’orbitale pi de liaison, les deux lobes ombrés des orbitales p interagissent de manière constructive l’un avec l’autre, tout comme les deux lobes non ombrés (rappelez-vous, le choix arbitraire de l’ombrage représente les signes (+) et (-) mathématiques pour la fonction d’onde mathématique décrivant l’orbitale). Il y a une densité accrue d’électrons entre les deux noyaux de carbone dans l’orbitale moléculaire – c’est une interaction de liaison.
Dans l’orbitale pi* antibondante de plus haute énergie, le lobe ombré d’une orbitale p interagit de manière destructive avec le lobe non ombré de la seconde orbitale p, ce qui entraîne un nœud entre les deux noyaux et une répulsion globale entre les noyaux de carbone.
En utilisant à nouveau le principe de » construction « , nous plaçons les deux électrons dans l’orbitale moléculaire pi de liaison, de plus faible énergie. L’orbitale pi* antiliante reste vide.
Puis, nous allons considérer la molécule de 1,3-butadiène. D’après la seule théorie des orbitales de valence, on pourrait s’attendre à ce que la liaison C2-C3 de cette molécule, parce qu’il s’agit d’une liaison sigma, puisse tourner librement.

Expérimentalement, on observe cependant qu’il existe une barrière importante à la rotation autour de la liaison C2-C3, et que la molécule entière est plane. En outre, la liaison C2-C3 a une longueur de 148 pm, plus courte qu’une simple liaison carbone-carbone typique (environ 154 pm), bien que plus longue qu’une double liaison typique (environ 134 pm).
La théorie des orbitales moléculaires rend compte de ces observations avec le concept de liaisons pi délocalisées. Dans cette image, les quatre orbitales atomiques 2p se combinent mathématiquement pour former quatre orbitales moléculaires pi d’énergie croissante. Deux d’entre elles – les orbitales pi de liaison – ont une énergie inférieure à celle des orbitales atomiques p à partir desquelles elles sont formées, tandis que deux – les orbitales pi* d’anti liaison – ont une énergie supérieure.

L’orbitale moléculaire de plus faible énergie, pi1, n’a qu’une interaction constructive et zéro nœud. Plus élevée en énergie, mais toujours inférieure aux orbitales p isolées, l’orbitale pi2 possède un nœud mais deux interactions constructives – il s’agit donc toujours d’une orbitale de liaison dans l’ensemble. Si l’on regarde les deux orbitales antiliantes, pi3* a deux nœuds et une interaction constructive, tandis que pi4* a trois nœuds et zéro interaction constructive.
Selon le principe d’aufbau, les quatre électrons des orbitales atomiques 2pz isolées sont placés dans les MO de liaison pi1 et pi2. Comme pi1 comprend une interaction constructive entre C2 et C3, il existe un degré, dans la molécule de 1,3-butadiène, d’interaction de liaison pi entre ces deux carbones, ce qui explique sa longueur plus courte et la barrière à la rotation. L’image de la liaison de valence du 1,3-butadiène montre que les deux liaisons pi sont isolées l’une de l’autre, chaque paire d’électrons pi étant « coincée » dans sa propre liaison pi. Cependant, la théorie des orbitales moléculaires prédit (avec précision) que les quatre électrons pi sont dans une certaine mesure délocalisés, ou » répartis « , sur l’ensemble du système pi.
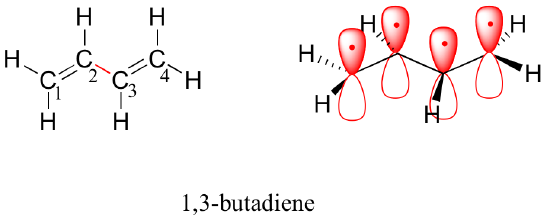
Vue de remplissage d’espace
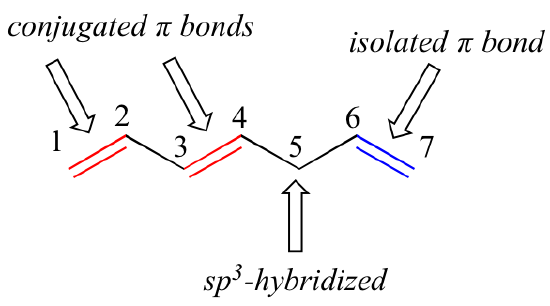
Le 1,3-butadiène est l’exemple le plus simple d’un système de liaisons pi conjuguées. Pour être considérées comme conjuguées, deux ou plusieurs liaisons pi doivent être séparées par une seule liaison simple – en d’autres termes, il ne peut y avoir de carbone intermédiaire hybridé sp3, car cela briserait le système de chevauchement des orbitales p parallèles. Dans le composé ci-dessous, par exemple, les doubles liaisons C1-C2 et C3-C4 sont conjuguées, tandis que la double liaison C6-C7 est isolée des deux autres liaisons pi par C5 hybridé sp3.
Un concept très important à garder à l’esprit est qu’il existe une stabilité thermodynamique inhérente associée à la conjugaison. Cette stabilité peut être mesurée expérimentalement en comparant la chaleur d’hydrogénation de deux diènes différents. (L’hydrogénation est un type de réaction dont nous apprendrons beaucoup plus au chapitre 15 : il s’agit essentiellement du processus d’ajout d’une molécule d’hydrogène – deux protons et deux électrons – à une liaison p). Lorsque les deux doubles liaisons conjuguées du 1,3-pentadiène sont « hydrogénées » pour produire du pentane, environ 225 kJ sont libérés par mole de pentane formé. Comparez cela aux quelque 250 kJ/mol libérés lorsque les deux doubles liaisons isolées du 1,4-pentadiène sont hydrogénées, formant également du pentane.
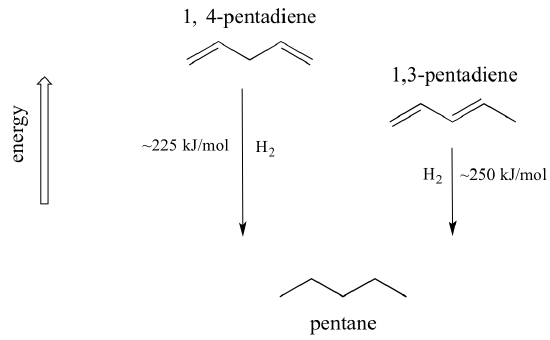
Le diène conjugué a une énergie plus faible : autrement dit, il est plus stable. En général, les liaisons pi conjuguées sont plus stables que les liaisons pi isolées.
Les systèmes pi conjugués peuvent impliquer des atomes d’oxygène et d’azote ainsi que du carbone. Dans le métabolisme des molécules de graisse, certaines des réactions clés impliquent des alcènes qui sont conjugués à des groupes carbonyles.

Au chapitre 4, nous verrons que la théorie MO est très utile pour expliquer pourquoi les molécules organiques qui contiennent des systèmes étendus de liaisons pi conjuguées ont souvent des couleurs distinctives. Le bêta-carotène, le composé responsable de la couleur orange des carottes, possède un système étendu de 11 liaisons pi conjuguées.
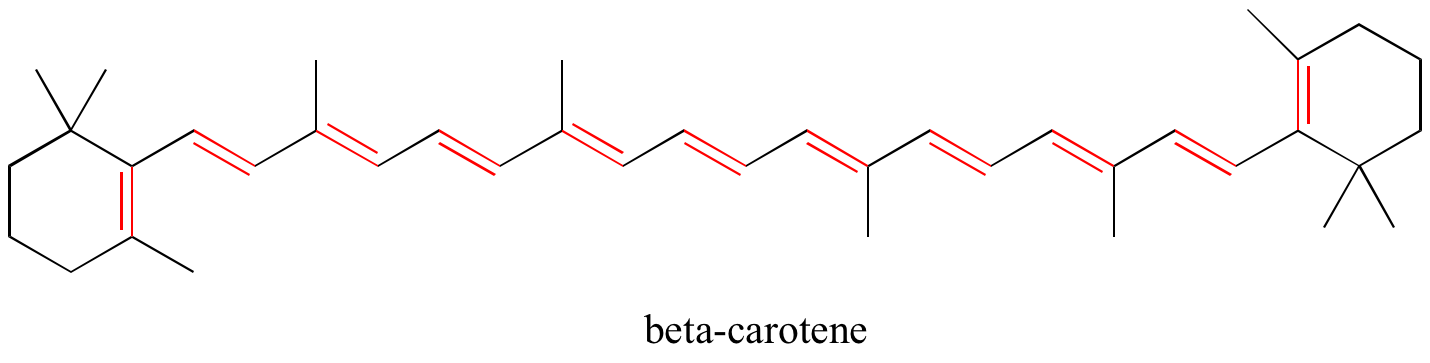
Exercice : Identifiez toutes les doubles liaisons conjuguées et isolées dans les structures ci-dessous. Pour chaque système pi conjugué, précisez le nombre d’orbitales p qui se chevauchent, et combien d’électrons pi sont partagés entre elles.
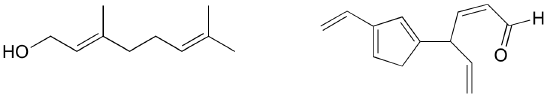
Exercice : Identifiez toutes les liaisons pi isolées et conjuguées dans le lycopène, le composé de couleur rouge des tomates. Combien d’électrons pi sont contenus dans le système pi conjugué ?
Solutions des exercices
Aromaticité – Le système conjugué ultime
La théorie des orbitales moléculaires est particulièrement utile pour expliquer les propriétés uniques des composés aromatiques tels que le benzène :
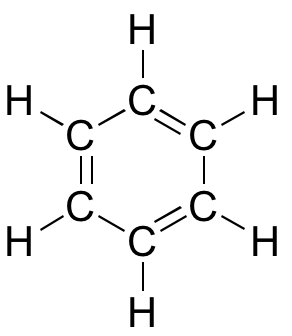
Modèle interactif 3D du benzène
Bien que le benzène soit le plus souvent dessiné avec trois doubles liaisons et trois liaisons simples, en fait toutes les liaisons carbone-carbone i sont exactement de la même longueur (138 pm). En outre, les liaisons pi du benzène sont nettement moins réactives que les liaisons pi « normales », qu’elles soient isolées ou conjuguées. Quelque chose dans la structure du benzène rend son arrangement de liaisons pi particulièrement stable. Ce » quelque chose » a un nom : on l’appelle » aromaticité « .
Quelle est exactement cette propriété » aromatique » qui rend les liaisons pi du benzène si stables ? En grande partie, la réponse à cette question réside dans le fait que le benzène est une molécule cyclique dans laquelle tous les atomes du cycle sont hybridés sp2. Cela permet aux électrons pi d’être délocalisés dans des orbitales moléculaires qui s’étendent tout autour de l’anneau, au-dessus et au-dessous du plan. Pour que cela se produise, il faut bien sûr que le cycle soit plan, sinon les orbitales p ne pourraient pas se chevaucher correctement. Le benzène est en effet connu pour être une molécule plane.
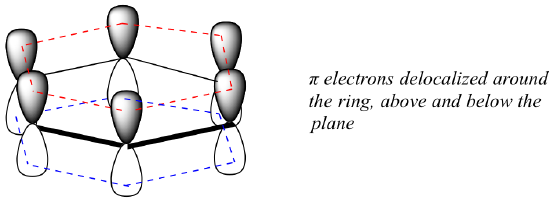
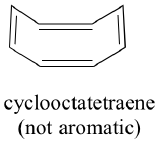
Toutes les molécules cycliques avec alternance de liaisons simples et doubles ont-elles cette même stabilité aromatique ? La réponse, en fait, est » non « . Le cycle cyclooctatétraène à huit chaînons représenté ci-dessous n’est pas plat, et ses liaisons π réagissent comme des alcènes » normaux « .
Il faut clairement quelque chose de plus pour être aromatique, et cela s’explique mieux par la théorie des orbitales moléculaires. Examinons un diagramme énergétique des orbitales moléculaires pi du benzène.
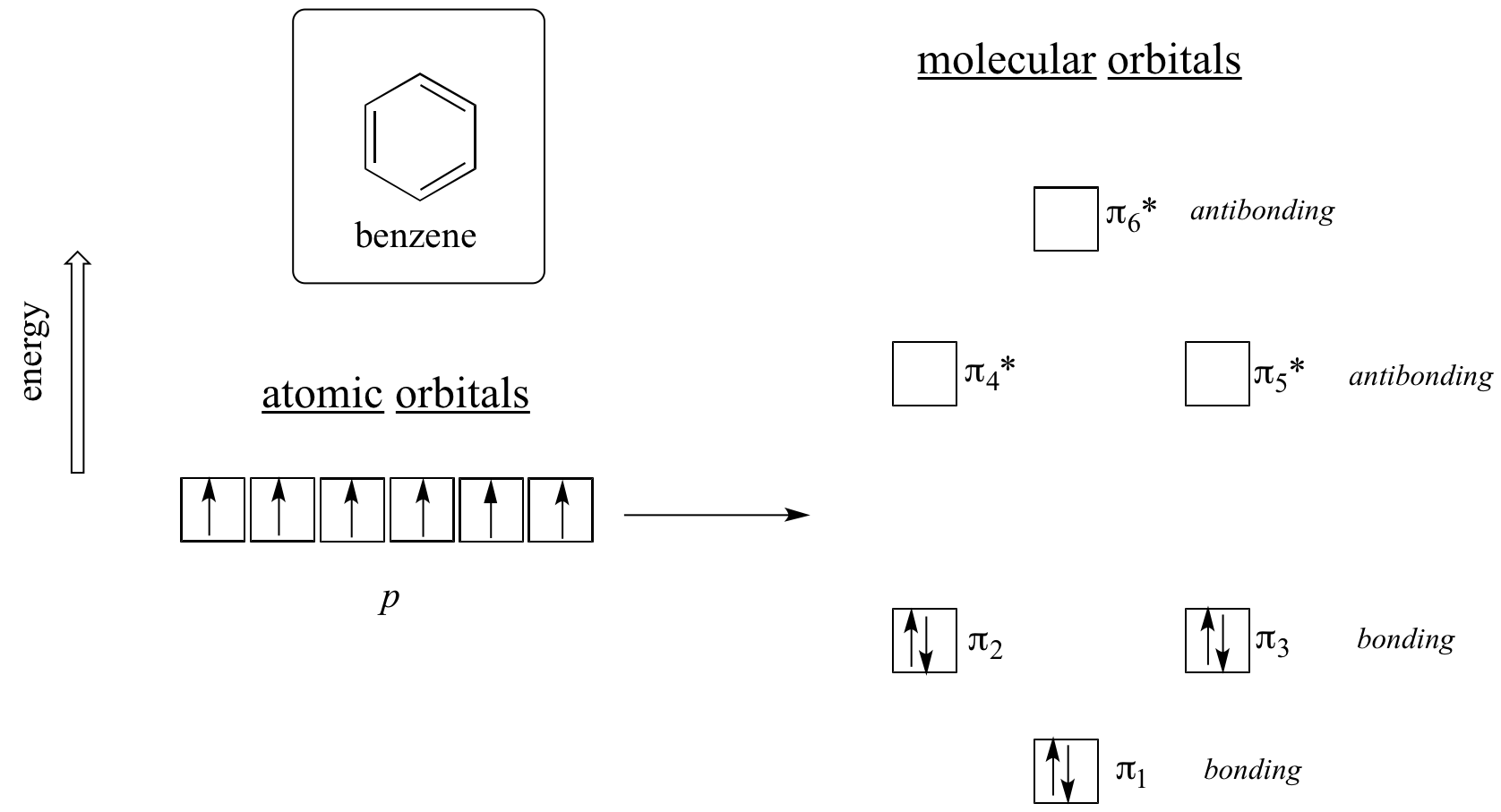
Les calculs de mécanique quantique nous indiquent que les six orbitales moléculaires pi du benzène, formées à partir de six orbitales p atomiques, occupent quatre niveaux d’énergie distincts. pi1 et pi6* ont des niveaux d’énergie uniques, tandis que les paires pi2 – pi3 et pi4*- pi5* sont dégénérées, ce qui signifie qu’elles se trouvent au même niveau d’énergie. Lorsque nous utilisons le principe d’aufbau pour remplir ces orbitales avec les six électrons pi du benzène, nous constatons que les orbitales de liaison sont complètement remplies et que les orbitales d’anti liaison sont vides. Cela nous donne un bon indice de la source de la stabilité particulière du benzène : un ensemble complet d’orbitales de liaison est similaire à bien des égards à la » coquille complète » d’électrons dans les orbitales atomiques des gaz nobles stables que sont l’hélium, le néon et l’argon.
Maintenant, faisons la même chose pour le cyclooctatétraène, dont nous avons déjà appris qu’il n’est pas aromatique.
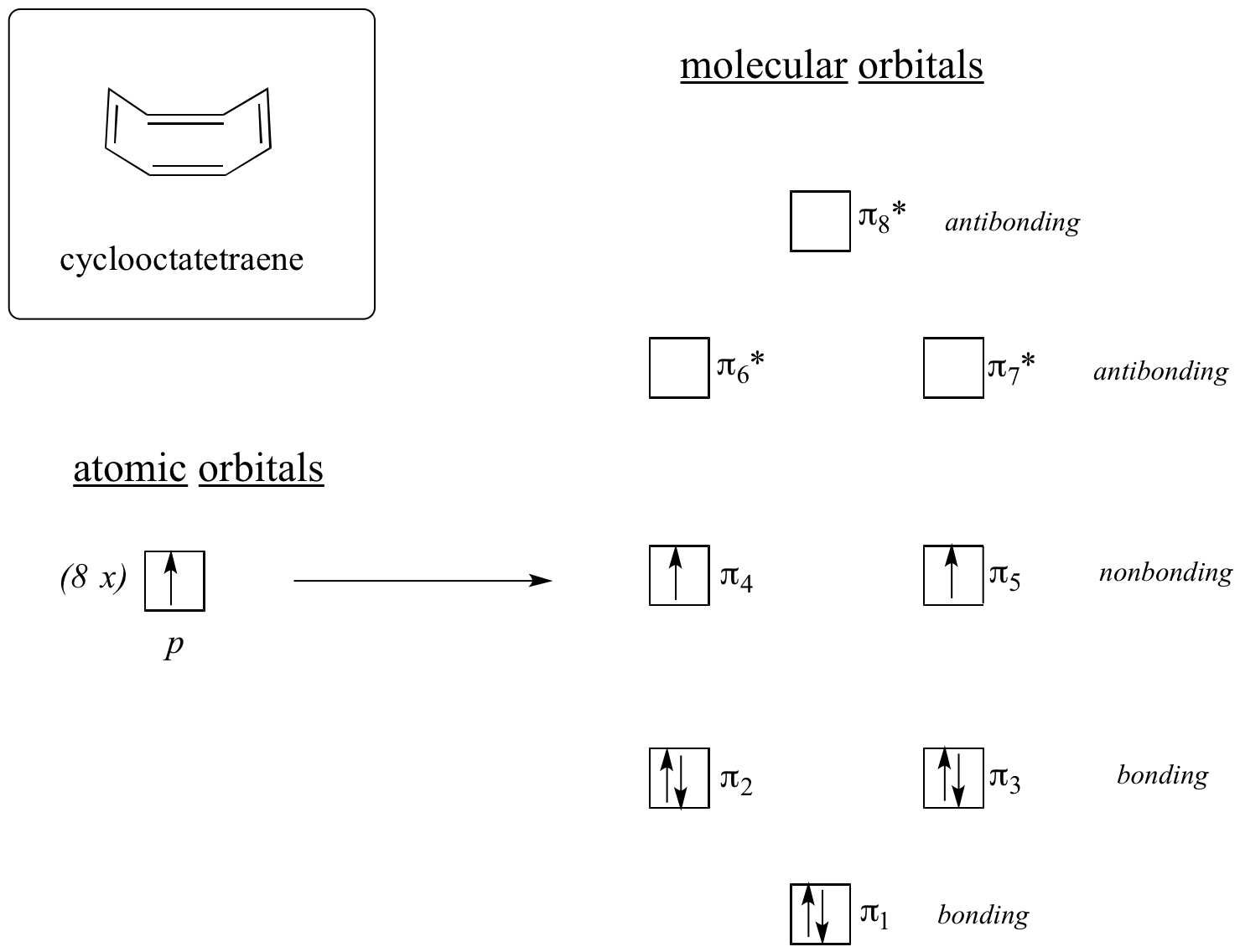
Le résultat des calculs d’orbitales moléculaires nous indique que les MO les plus basses et les plus élevées (pi1 et pi8*) ont des niveaux d’énergie uniques, tandis que les six autres forment des paires dégénérées. Remarquez que pi4 et pi5 se trouvent au même niveau d’énergie que les orbitales atomiques 2pz isolées : il ne s’agit donc ni de liaisons ni d’antiliaisons, mais de MO non liants. En remplissant les MO avec les huit électrons pi de la molécule, nous constatons que les deux derniers électrons sont non appariés et tombent dans les deux orbitales non liantes dégénérées. Comme nous n’avons pas une coquille parfaitement remplie de MO de liaison, notre molécule n’est pas aromatique. En conséquence, chacune des doubles liaisons dans le cyclooctatétraène agit plutôt comme une double liaison isolée.
Pour l’instant, l’objectif d’apprentissage important est de reconnaître les systèmes de liaisons pi conjuguées et de comprendre que le benzène est exceptionnellement stable présentant une propriété appelée aromaticité. L’aromaticité et la chimie des composés aromatiques sont relativement complexes et sont abordées plus en détail dans les chapitres suivants de ce texte.
Chimie organique avec une emphase biologique par Tim Soderberg (Université du Minnesota, Morris)
.