Dosage Form: powder for oral suspension
Medically reviewed by Drugs.com. Last updated on April 1, 2019.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
- INDICATIONS & USAGE
- Respiratory Tract Infections
- Otitis Media
- Infections de la peau et des structures cutanées
- Infections osseuses
- Infections des voies génito-urinaires
- Utilisation
- DOSAGE & ADMINISTRATION
- Adultes et patients pédiatriques âgés d’au moins 15 ans
- Enfants (âgés de plus d’un an)
- Ajustements de la posologie chez les adultes et les enfants âgés d’au moins 15 ans présentant une insuffisance rénale
- FORMES POSOLOGIQUES & FORCES
- Contre-indications
- Avertissements et précautions
- Réactions d’hypersensibilité
- Diarrhée associée à Clostridium difficile
- Séroconversion du test de Coombs direct
- Potentiel convulsif
- Temps de prothrombine prolongé
- Développement de bactéries résistantes aux médicaments
- Effets indésirables
- Expérience des essais cliniques
- Interactions médicamenteuses
- Metformine
- Probénécide
- Interaction avec les tests de laboratoire ou de diagnostic
- Utilisation dans des populations particulières
- Grossesse
- Mères allaitantes
- Utilisation pédiatrique
- Utilisation gériatrique
- Insuffisance rénale
- Surdosage
- Description de la suspension de céphalexine
- Suspension de céphalexine – Pharmacologie clinique
- Mécanisme d’action
- Pharmacocinétique
- Microbiologie
- Nonclinical Toxicology
- Carcinogenesis & Mutagenesis & Impairment Of Fertility
- How Supplied/Storage and Handling
- Information sur les conseils aux patients
- ÉTIQUETTE DE L’EMBALLAGE.PANNEAU D’AFFICHAGE PRINCIPAL
- Frequently asked questions
- More about cephalexin
- Consumer resources
- Professional resources
- Related treatment guides
INDICATIONS & USAGE
Respiratory Tract Infections
Cephalexin is indicated for the treatment of respiratory tract infections caused by susceptible isolates of Streptococcus pneumoniae and Streptococcus pyogenes.
Otitis Media
Cephalexin is indicated for the treatment of otitis media caused by susceptible isolates of Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes, and Moraxella catarrhalis.
Infections de la peau et des structures cutanées
La céphalexine est indiquée pour le traitement des infections de la peau et des structures cutanées causées par des isolats sensibles des bactéries à Gram positif suivantes : Staphylococcus aureus et Streptococcus pyogenes.
Infections osseuses
La céphalexine est indiquée pour le traitement des infections osseuses causées par des isolats sensibles de Staphylococcus aureus et Proteus mirabilis.
Infections des voies génito-urinaires
La céphalexine est indiquée pour le traitement des infections des voies génito-urinaires, y compris la prostatite aiguë, causées par des isolats sensibles d’Escherichia coli, Proteus mirabilis et Klebsiella pneumoniae.
Utilisation
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l’efficacité de la céphalexine et des autres médicaments antibactériens, la céphalexine doit être utilisée uniquement pour traiter les infections dont il est prouvé ou fortement soupçonné qu’elles sont causées par des bactéries sensibles. Lorsque des données sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte dans le choix ou la modification du traitement antibactérien. En l’absence de telles données, l’épidémiologie locale et les profils de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE & ADMINISTRATION
Adultes et patients pédiatriques âgés d’au moins 15 ans
La dose habituelle de céphalexine orale est de 250 mg toutes les 6 heures, mais une dose de 500 mg toutes les 12 heures peut être administrée. Le traitement est administré pendant 7 à 14 jours.
Pour des infections plus sévères, des doses plus importantes de céphalexine orale peuvent être nécessaires, jusqu’à 4 grammes par jour en deux à quatre doses également réparties.
Enfants (âgés de plus d’un an)
La dose quotidienne totale recommandée de céphalexine orale pour les enfants est de 25 à 50 mg/kg administrée en doses également réparties pendant 7 à 14 jours. Dans le traitement des infections à streptocoques β-hémolytiques, une durée d’au moins 10 jours est recommandée. In severe infections, a total daily dose of 50 to 100 mg/kg may be administered in equally divided doses.
For the treatment of otitis media, the recommended daily dose is 75 to 100 mg/kg given in equally divided doses.
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
Cephalexin Suspension 125mg/5mL ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. 2 to 4 tsp q.i.d. |
250mg/5mL ¼ to ½ tsp q.i.d. ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. |
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
125mg/5mL 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. 4 to 8 tsp b.i.d. |
250mg/5mL ½ to 1 tsp b.i.d 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. |
Directions pour le mélange
125 mg par 5 ml (100 ml une fois mélangé) : Préparer le temps de suspension à la distribution. Ajouter au flacon un total de 67 mL d’eau. Pour faciliter la préparation, tapoter le flacon pour détacher la poudre, ajouter l’eau en 2 fois, en agitant bien après chaque ajout. La suspension obtenue contiendra de la céphalexine monohydratée équivalente à 125 mg de céphalexine dans chaque 5 mL (cuillerée à café).
125 mg par 5 mL (200 mL une fois mélangé) : Préparer le temps de suspension à la distribution. Ajouter au flacon un total de 134 mL d’eau. Pour faciliter la préparation, tapoter le flacon pour détacher la poudre, ajouter l’eau en 2 fois, en agitant bien après chaque ajout. La suspension obtenue contiendra de la céphalexine monohydratée équivalente à 125 mg de céphalexine dans chaque 5 mL (cuillerée à café).
250 mg par 5 mL (100 mL une fois mélangé) : Préparer le temps de suspension à la distribution. Ajouter au flacon un total de 67 mL d’eau. Pour faciliter la préparation, tapoter le flacon pour détacher la poudre, ajouter l’eau en 2 fois, en agitant bien après chaque ajout. La suspension obtenue contiendra de la céphalexine monohydratée équivalente à 250 mg de céphalexine dans chaque 5 mL (cuillerée à café).
250 mg par 5 mL (200 mL une fois mélangé) : Préparer le temps de suspension à la distribution. Ajouter au flacon un total de 134 mL d’eau. Pour faciliter la préparation, tapoter le flacon pour détacher la poudre, ajouter l’eau en 2 fois, en agitant bien après chaque ajout. La suspension obtenue contiendra de la céphalexine monohydratée équivalente à 250 mg de céphalexine dans chaque 5 mL (cuillerée à café).
*Après mélange, conserver au réfrigérateur. Peut être conservé pendant 14 jours sans perte significative d’activité.
Ajustements de la posologie chez les adultes et les enfants âgés d’au moins 15 ans présentant une insuffisance rénale
Administrer les schémas posologiques suivants pour la céphalexine aux patients présentant une insuffisance rénale .
Tableau 1. Recommended Dose Regimen for Patients with Renal Impairment
| Renal function | Dose regimen recommendation |
| Creatinine clearance ≥60 mL/min | No dose adjustment |
| Creatinine clearance 30 to 59 mL/min | No dose adjustment; maximum daily dose should not exceed 1 g |
| Creatinine clearance 15 to 29 mL/min | 250 mg, every 8 hours or every 12 hours |
| Creatinine clearance 5 to 14 mL/min not yet on dialysis* | 250 mg, every 24 hours |
| Creatinine clearance 1 to 4 mL/min not yet on dialysis* | 250 mg, toutes les 48 heures ou toutes les 60 heures |
*Les informations sont insuffisantes pour formuler des recommandations d’adaptation de la dose chez les patients sous hémodialyse.
FORMES POSOLOGIQUES & FORCES
Céphalexine pour suspension orale USP
125 mg/5mL et 250 mg/5mL
Contre-indications
.
La céphalexine est contre-indiquée chez les patients présentant une hypersensibilité connue à la céphalexine ou à d’autres membres de la classe des céphalosporines, des médicaments antibactériens.
Avertissements et précautions
Réactions d’hypersensibilité
Des réactions allergiques sous forme d’éruption cutanée, d’urticaire, d’angioedème, d’anaphylaxie, d’érythème polymorphe, de syndrome de Stevens-Johnson ou de nécrolyse épidermique toxique ont été rapportées lors de l’utilisation de la céphalexine. Avant d’instaurer un traitement par la céphalexine, il faut demander au patient s’il a des antécédents de réactions d’hypersensibilité à la céphalexine, aux céphalosporines, aux pénicillines ou à d’autres médicaments. Une hypersensibilité croisée entre les antibactériens bêta-lactamines peut se produire chez jusqu’à 10 % des patients ayant des antécédents d’allergie à la pénicilline.
Si une réaction allergique à la céphalexine se produit, arrêtez le médicament et instituez un traitement approprié.
Diarrhée associée à Clostridium difficile
La diarrhée associée à Clostridium difficile (DACD) a été rapportée lors de l’utilisation de presque tous les agents antibactériens, y compris la céphalexine, et peut être de gravité variable, allant d’une diarrhée légère à une colite mortelle. Le traitement par des agents antibactériens modifie la flore normale du côlon, ce qui entraîne une prolifération de C. difficile.
C. difficile produit des toxines A et B, qui contribuent au développement de la CDAD. Les souches de C. difficile produisant des hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée après avoir pris des antibiotiques. Des antécédents médicaux minutieux sont nécessaires puisque la DACD a été signalée comme pouvant survenir plus de deux mois après l’administration d’agents antibactériens.
Si la DACD est suspectée ou confirmée, l’utilisation continue d’antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique contre le C. difficile et une évaluation chirurgicale doivent être instaurés selon les indications cliniques.
Séroconversion du test de Coombs direct
Des tests de Coombs directs positifs ont été rapportés pendant le traitement par les antibactériens de la famille des céphalosporines, y compris la céphalexine. Des cas d’hémolyse intravasculaire aiguë induite par un traitement à la céphalexine ont été rapportés. Si une anémie se développe pendant ou après un traitement par la céphalexine, effectuer un bilan diagnostique pour une anémie hémolytique induite par le médicament, arrêter la céphalexine et instaurer un traitement approprié.
Potentiel convulsif
Plusieurs céphalosporines ont été impliquées dans le déclenchement de crises convulsives, en particulier chez les patients atteints d’insuffisance rénale lorsque la posologie n’était pas réduite. En cas de crises convulsives, arrêter la céphalexine. Un traitement anticonvulsivant peut être administré si cela est cliniquement indiqué.
Temps de prothrombine prolongé
Les céphalosporines peuvent être associées à un temps de prothrombine prolongé. Les personnes à risque sont les patients souffrant d’insuffisance rénale ou hépatique, ou d’un mauvais état nutritionnel, ainsi que les patients recevant un traitement antibactérien prolongé, et les patients recevant un traitement anticoagulant. Surveiller le temps de prothrombine chez les patients à risque et prendre en charge comme indiqué.
Développement de bactéries résistantes aux médicaments
Prescrire de la céphalexine en l’absence d’une infection bactérienne avérée ou fortement suspectée est peu susceptible d’apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
L’utilisation prolongée de la céphalexine peut entraîner la prolifération d’organismes non sensibles. Une observation attentive du patient est essentielle. Si une surinfection survient pendant le traitement, des mesures appropriées doivent être prises.
Effets indésirables
Les événements graves suivants sont décrits plus en détail dans la rubrique Mises en garde et précautions d’emploi :
– Réactions d’hypersensibilité
– Diarrhée associée à Clostridium difficile
– Séroconversion du test de Coombs direct
– Potentiel convulsif
– Effet sur l’activité de la prothrombine
– Développement de bactéries résistantes au médicament
Expérience des essais cliniques
Parce que les essais cliniques sont réalisés dans des conditions très variables, les taux d’effets indésirables observés dans les essais cliniques d’un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d’un autre médicament et peuvent ne pas refléter les taux observés en pratique.
Dans les essais cliniques, l’effet indésirable le plus fréquent était la diarrhée. Des nausées et des vomissements, des dyspepsies, des gastrites et des douleurs abdominales sont également survenus. Comme avec les pénicillines et d’autres céphalosporines, une hépatite transitoire et un ictère cholestatique ont été rapportés.
Les autres réactions ont inclus des réactions d’hypersensibilité, un prurit génital et anal, une candidose génitale, une vaginite et des pertes vaginales, des vertiges, une fatigue, des céphalées, une agitation, une confusion, des hallucinations, une arthralgie, une arthrite et un trouble articulaire. Une néphrite interstitielle réversible a été signalée. Une éosinophilie, une neutropénie, une thrombocytopénie, une anémie hémolytique et de légères élévations de l’aspartate transaminase (AST) et de l’alanine transaminase (ALT) ont été rapportées.
En plus des effets indésirables énumérés ci-dessus qui ont été observés chez les patients traités par la céphalexine, les effets indésirables suivants et d’autres tests de laboratoire modifiés ont été rapportés pour les antibactériens de la classe des céphalosporines :
Autres effets indésirables : Fièvre, colite, anémie aplastique, hémorragie, dysfonctionnement rénal et néphropathie toxique.
Tests de laboratoire altérés : Temps de prothrombine prolongé, augmentation de l’azote uréique du sang (BUN), augmentation de la créatinine, phosphatase alcaline élevée, bilirubine élevée, lactate déshydrogénase (LDH) élevée, pancytopénie, leucopénie et agranulocytose.
Interactions médicamenteuses
Metformine
L’administration de céphalexine avec la metformine entraîne une augmentation des concentrations plasmatiques de metformine et une diminution de la clairance rénale de la metformine.
Une surveillance attentive du patient et un ajustement de la dose de metformine sont recommandés chez les patients prenant de manière concomitante de la céphalexine et de la metformine .
Probénécide
L’excrétion rénale de la céphalexine est inhibée par le probénécide. L’administration simultanée de probénécide et de céphalexine n’est pas recommandée.
Interaction avec les tests de laboratoire ou de diagnostic
Une réaction faussement positive peut se produire lors de la recherche de la présence de glucose dans l’urine à l’aide de la solution de Benedict ou de la solution de Fehling.
Utilisation dans des populations particulières
Grossesse
Grossesse catégorie B
Il n’existe pas d’études adéquates et bien contrôlées chez la femme enceinte. Les études de reproduction chez l’animal n’étant pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
Des études de reproduction ont été réalisées sur des souris et des rats en utilisant des doses orales de céphalexine monohydratée de 0.6 et 1,5 fois la dose quotidienne maximale chez l’homme (66 mg/kg/jour) sur la base de la surface corporelle, et n’ont révélé aucun signe d’altération de la fertilité ou de préjudice pour le fœtus.
Mères allaitantes
La céphalexine est excrétée dans le lait maternel. La prudence est de mise lorsque la céphalexine est administrée à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l’efficacité de la céphalexine chez les patients pédiatriques ont été établies lors d’essais cliniques pour les doses décrites dans la section posologie et administration.
Utilisation gériatrique
Sur les 701 sujets de 3 études cliniques publiées sur la céphalexine, 433 (62%) avaient 65 ans et plus. Aucune différence globale de sécurité ou d’efficacité n’a été observée entre ces sujets et les sujets plus jeunes, et d’autres expériences cliniques rapportées n’ont pas identifié de différences de réponses entre les personnes âgées et les patients plus jeunes.
Ce médicament est en grande partie excrété par les reins, et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients ayant une fonction rénale altérée. Les patients âgés étant plus susceptibles de présenter une diminution de la fonction rénale, il convient d’être prudent dans le choix de la dose .
Insuffisance rénale
La céphalexine doit être administrée avec prudence en présence d’une fonction rénale altérée (clairance de la créatinine < 30 ml/min, avec ou sans dialyse). Dans ces conditions, une observation clinique attentive et des études de laboratoire de surveillance de la fonction rénale doivent être menées car la posologie sûre peut être inférieure à celle habituellement recommandée .
Surdosage
Les symptômes de surdosage oral peuvent inclure des nausées, des vomissements, une détresse épigastrique, une diarrhée et une hématurie. En cas de surdosage, instituer des mesures générales de soutien.
La diurèse forcée, la dialyse péritonéale, l’hémodialyse ou l’hémoperfusion au charbon n’ont pas été établies comme bénéfiques pour un surdosage de céphalexine.
Description de la suspension de céphalexine
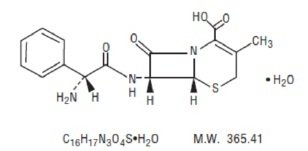
La suspension orale de céphalexine, USP est un médicament antibactérien de type céphalosporine semi-synthétique destiné à l’administration orale. Il s’agit de l’acide 7-(D-α-amino-α-phénylacétamido)-3-méthyl-3-céphem-4-carboxylique monohydraté. La céphalexine a pour formule moléculaire C16H17N3O4S-H2O et son poids moléculaire est de 365,41.
La céphalexine a la formule structurelle suivante :
Ingrédients inactifs : Dioxyde de silicium colloïdal, FD&C Rouge # 40, méthylcellulose (15 premium LV), méthylcellulose (4AC premium), benzoate de sodium, arôme de fraise, saccharose, gomme xanthane.
Suspension de céphalexine – Pharmacologie clinique
Mécanisme d’action
La céphalexine est un médicament antibactérien de la famille des céphalosporines .
Pharmacocinétique
Absorption:
La céphalexine est stable aux acides et peut être administrée sans tenir compte des repas. Après des doses de 250 mg, 500 mg et 1 g, des pics sériques moyens d’environ 9, 18 et 32 mcg/mL, respectivement, ont été obtenus à 1 heure. Les taux sériques étaient détectables 6 heures après l’administration (à un niveau de détection de 0,2 mcg/mL).
Distribution :
La céphalexine est liée aux protéines plasmatiques à hauteur d’environ 10 % à 15 %.
Excrétion :
La céphalexine est excrétée dans l’urine par filtration glomérulaire et sécrétion tubulaire. Des études ont montré que plus de 90 % du médicament était excrété sous forme inchangée dans l’urine dans les 8 heures. Au cours de cette période, les concentrations urinaires maximales après les doses de 250 mg, 500 mg et 1 g étaient respectivement d’environ 1 000, 2 200 et 5 000 mcg/mL.
Interactions médicamenteuses :
Chez des sujets sains ayant reçu des doses uniques de 500 mg de céphalexine et de metformine, la Cmax et l’ASC moyennes de la metformine dans le plasma ont augmenté en moyenne de 34 % et 24 %, respectivement, et la clairance rénale moyenne de la metformine a diminué de 14 %. Aucune information n’est disponible sur l’interaction entre la céphalexine et la metformine après l’administration de doses multiples de l’un ou l’autre médicament.
Microbiologie
Mécanisme d’action
La céphalexine est un agent bactéricide qui agit par inhibition de la synthèse de la paroi cellulaire bactérienne.
Résistance
Les staphylocoques résistants à la méthicilline et la plupart des isolats d’entérocoques sont résistants à la céphalexine. La céphalexine n’est pas active contre la plupart des isolats d’Enterobacter spp, de Morganella morganii et de Proteus vulgaris. La céphalexine n’est pas active contre les Pseudomonas spp. et les Acinetobacter calcoaceticus. Streptococcus pneumoniae résistant à la pénicilline présente généralement une résistance croisée aux antibactériens bêta-lactamines.
Activité antimicrobienne
La céphalexine s’est avérée active contre la plupart des isolats des bactéries suivantes, à la fois in vitro et dans des infections cliniques .
Bactéries gram-positives
Staphylococcus aureus (isolats sensibles à la méthicilline uniquement) Streptococcus pneumoniae (isolats sensibles à la pénicilline) Streptococcus pyogenes
Bactéries gram-.négatif Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Tests de sensibilité
Pour des informations spécifiques concernant les critères d’interprétation des tests de sensibilité et les méthodes de test associées ainsi que les normes de contrôle de qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Nonclinical Toxicology
Carcinogenesis & Mutagenesis & Impairment Of Fertility
Lifetime studies in animals have not been performed to evaluate the carcinogenic potential of cephalexin. Tests to determine the mutagenic potential of cephalexin have not been performed. In male and female rats, fertility and reproductive performance were not affected by cephalexin oral doses up to 1.5 times the highest recommended human dose based upon body surface area.
How Supplied/Storage and Handling
Cephalexin for oral suspension* USP (a strawberry flavored formula) is supplied as follows:
125 mg/5 mL:
Bottles of 100 mL (NDC 67877-544-88)
Bottles of 200 mL (NDC 67877-544-68)
250 mg/5 mL:
Bottles of 100 mL (NDC 67877-545-88)
Bottles of 200 mL (NDC 67877-545-68)
Directions for mixing are included on the label.
Réservez entre 20o et 25o C (68o à 77o F) .
Bougez bien avant de l’utiliser. Garder hermétiquement fermé.
*Après le mélange, conserver au réfrigérateur. Peut être conservé pendant 14 jours sans perte significative de puissance.
Information sur les conseils aux patients
- Avertissez les patients que des réactions allergiques, y compris des réactions allergiques graves, pourraient se produire et que les réactions graves nécessitent un traitement immédiat. Demandez au patient s’il a déjà eu des réactions d’hypersensibilité à la céphalexine, à d’autres bêta-lactamines (y compris les céphalosporines) ou à d’autres allergènes (5.1)
- Avertissez les patients que la diarrhée est un problème courant causé par les antibactériens et qu’elle disparaît généralement à l’arrêt du médicament. Parfois, une diarrhée aqueuse ou sanglante fréquente peut survenir et peut être le signe d’une infection intestinale plus grave. En cas de diarrhée aqueuse ou sanglante sévère, conseillez aux patients de contacter leur professionnel de santé.
- Conseillez aux patients que les médicaments antibactériens, y compris la céphalexine, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque la céphalexine est prescrite pour traiter une infection bactérienne, dites aux patients que même s’il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l’efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent plus être traitées par la céphalexine ou d’autres médicaments antibactériens à l’avenir.
Fabriqué en Inde par :
Alkem Laboratories Ltd,
Mumbai – 400013, INDE.
Distribué par :
Ascend Laboratories, LLC
Parsippany, NJ 07054
Révisé : Décembre, 2018
PT 2851
ÉTIQUETTE DE L’EMBALLAGE.PANNEAU D’AFFICHAGE PRINCIPAL
NDC 67877-544-88
Céphalexine pour suspension orale, USP 125 mg par 5 mL
lorsque reconstituée selon les instructions.
Dose pédiatrique usuelle : 25 à 50 mg par kg par jour en quatre doses divisées. Pour une infection plus sévère, la dose peut être doublée. Voir la documentation d’accompagnement.
Rx seulement
Pour usage oral seulement
100 mL (lorsque mélangé)
Ascend Laboratories, LLC

NDC 67877-545-88
Cephalexin for Oral Suspension, USP 250 mg par 5 mL
lorsque reconstitué selon les instructions.
Dose pédiatrique usuelle : 25 à 50 mg par kg par jour en quatre doses fractionnées. Pour une infection plus sévère, la dose peut être doublée.
Voir la documentation d’accompagnement.
Rx seulement
Pour usage oral seulement
100 mL (une fois mélangé)
Laboratoires Ascend, LLC

| CéPHALEXINE céphalexine pour suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| CEPHALEXIN cephalexin for suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Ascend Laboratories, LLC (141250469)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Alkem Laboratories Limited | 915628612 | MANUFACTURE(67877-544, 67877-545) | |
Frequently asked questions
- What are the best antibiotics for a tooth infection?
- Cephalexin – can this be used to treat an abscess in the mouth or gum infection?
- If people are allergic to amoxicillin can they take cephalexin?
- What is the best antibiotic to treat strep throat?
- Can you take cephalexin for a spider bite?
- Can you take antibiotics while pregnant?
- Cephalexin – is this a drug that can be abused by teens?
More about cephalexin
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Patient Tips
- Drug Images
- Drug Interactions
- Compare Alternatives
- Support Group
- Pricing & Coupons
- En Español
- 415 Reviews
- Drug class: first generation cephalosporins
Consumer resources
- Patient Information
- Cephalexin (Advanced Reading)
Professional resources
- Prescribing Information
- Cephalexin (Professional Patient Advice)
- Cephalexin (FDA)
- Cephalexin Tablets (FDA)
Other brands Keflex, Daxbia, Panixine
Related treatment guides
- Bacterial Infection
- Bladder Infection
- Bacterial Endocarditis Prevention
- Acne
- … +7 more
Medical Disclaimer