Calcul des degrés d’insaturation (DoU)
Le degré d’insaturation (DoU) est également connu sous le nom d’équivalent de la double liaison. Si la formule moléculaire est donnée, branchez les chiffres dans cette formule :
\
- C\) est le nombre de carbones
- N\) est le nombre de nitrogènes
- X\) est le nombre d’halogènes (F, Cl, Br, I)
- \(H\) est le nombre d’hydrogènes
Comme indiqué précédemment, une molécule saturée ne contient que des liaisons simples et aucun cycle. Une autre façon d’interpréter cela est qu’une molécule saturée possède le nombre maximum d’atomes d’hydrogène possible pour être un alcane acyclique. Ainsi, le nombre d’hydrogènes peut être représenté par 2C+2, qui est la représentation moléculaire générale d’un alcane. À titre d’exemple, pour la formule moléculaire C3H4, le nombre d’hydrogènes réels nécessaires pour que le composé soit saturé est de 8 . Le composé a besoin de 4 hydrogènes supplémentaires pour être totalement saturé (nombre d’hydrogènes attendus – nombre d’hydrogènes observés = 8-4=4). Le degré d’insaturation est égal à 2, soit la moitié du nombre d’hydrogènes dont la molécule a besoin pour être classée comme saturée. La formule DoB divise donc par 2. La formule soustrait le nombre de X car un halogène (X) remplace un hydrogène dans un composé. Par exemple, dans le chloroéthane, C2H5Cl, il y a un hydrogène de moins par rapport à l’éthane, C2H6.
Pour qu’un composé soit saturé, il y a un hydrogène de plus dans une molécule lorsque l’azote est présent. On ajoute donc le nombre de nitrogènes (N). C’est ce que l’on constate avec C3H9N par rapport à C3H8. L’oxygène et le soufre ne sont pas inclus dans la formule car la saturation n’est pas affectée par ces éléments. As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, les degrés d’insaturation ne donnent que la somme des doubles liaisons, triples liaisons et/ou cycles. Par exemple, un degré d’insaturation de 3 peut contenir 3 cycles, 2 cycles+1 double liaison, 1 cycle+2 doubles liaisons, 1 cycle+1 triple liaison, 1 double liaison+1 triple liaison, ou 3 doubles liaisons.
Exemple : Benzène
Quel est le degré d’insaturation du benzène ?
SOLUTION
La formule moléculaire du benzène est C6H6. Ainsi,
DoU= 4, où C=6, N=0,X=0, et H=6. 1 DoB peut correspondre à 1 cycle ou 1 double liaison. Cela correspond au benzène contenant 1 cycle et 3 doubles liaisons.
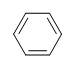
However, lorsqu’on lui donne la formule moléculaire C6H6, le benzène n’est qu’une des nombreuses structures possibles (isomères). Les structures suivantes ont toutes un DoB de 4 et ont la même formule moléculaire que le benzène.