Un atome auquel sont attachés quatre groupes peut aussi adopter une géométrie tétraédrique. Cette géométrie apparaît souvent lorsque l’atome central est un peu plus petit. Une géométrie tétraédrique permet aux groupes voisins de s’éloigner un peu les uns des autres.
Contrairement aux composés plans carrés, les composés tétraédriques simples n’ont pas le même type d’isomères cis- et trans-. En d’autres termes, deux groupes ne peuvent pas être placés sur un tétraèdre de façon à ce qu’ils soient opposés ou à côté l’un de l’autre. La relation entre deux groupes quelconques sur un tétraèdre est la même que la relation entre deux autres groupes quelconques sur un tétraèdre.
Le dichlorodiméthylsilane est un composé qui peut être utilisé pour fabriquer des polymères de silicone. Comme le platine, il possède deux groupes chacun attachés à l’atome central. Cependant, l’atome central est tétraédrique. There is only one way to arrange these four groups.
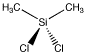
Figure SC3.1. A tetrahedral atom with two different types of groups attached, (CH3)2SiCl2.
However, if four different groups are attached to a tetrahedral atom, the four groups can be arranged in two possible ways. The two compounds that result are mirror images of each other. These two isomers are called enantiomers.
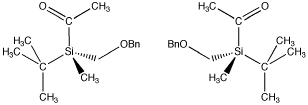
Figure SC3.2. A pair of enantiomers. The (-) enantiomer is on the left and the (+) enantiomer is on the right. Notez que l’atome de silicium tétraédrique a quatre groupes différents attachés.
- Les énantiomères sont des paires de composés ayant exactement la même connectivité mais des formes tridimensionnelles opposées.
- Les énantiomères ne sont pas identiques les uns aux autres ; un énantiomère ne peut pas être superposé à l’autre.
- Les énantiomères sont des images miroir l’un de l’autre.
Deux composés ayant exactement la même connectivité, qui sont des images miroir l’un de l’autre mais qui ne sont pas identiques l’un à l’autre sont appelés énantiomères. La définition la plus courante d’un énantiomère est qu’il n’est pas superposable à son image miroir. Il peut être distingué facilement de son image miroir, tout comme une main droite peut être facilement identifiée et distinguée d’une main gauche.
- Les composés qui se présentent sous la forme de ces paires sont appelés « chiraux ».
- « Chiral » vient du mot grec pour « main ».
On peut montrer en utilisant la théorie des groupes, les mathématiques de la symétrie, qu’un énantiomère peut aussi être défini comme une molécule qui ne contient pas de plan miroir, ce qui signifie qu’elle ne peut pas être divisée en deux moitiés identiques et opposées.
- Les énantiomères ne contiennent pas de plan miroir.
- Les énantiomères ne contiennent pas deux moitiés identiques et opposées.
Contrairement aux isomères cis et trans, deux énantiomères ont les mêmes propriétés physiques. ils ont le même point de fusion, la même solubilité, et ainsi de suite. Deux composés qui sont presque identiques, mais qui sont des images miroir l’un de l’autre, ont exactement les mêmes types d’attraction intermoléculaire, il n’est donc pas forcément surprenant que leurs propriétés physiques soient identiques.
- Les énantiomères sont un autre exemple de type de stéréoisomères.
- Deux énantiomères ont des propriétés physiques identiques, sauf pour la rotation optique.
La rotation optique implique l’interaction de la lumière polarisée plane avec un matériau. Si un matériau n’est pas symétrique, la lumière qui le traverse subit une rotation. Cela signifie que si les ondes qui composent la lumière oscillent dans une direction lorsqu’elles entrent dans le matériau, elles auront légèrement basculé pour osciller dans une autre direction lorsqu’elles sortiront du matériau. Nous verrons ce phénomène plus tard.
- Deux énantiomères ont un effet de rotation égal mais opposé sur la lumière polarisée plane.
- Les énantiomères (+) font tourner la lumière dans le sens des aiguilles d’une montre.
- (-) enantiomers rotate light in a counterclockwise direction.
For example, in the chiral silicon compound shown above, the (+) enantiomer rotates plane-polarized light in a clockwise direction. It has a « standard optical rotation » of = +12 (+/-2)o. The (-) enantiomer rotates plane-polarized light in a counterclockwise direction. It has a « standard optical rotation » of = -9.9 (+/-2)o.
Problem SC3.1.
A certain compound exists in two forms; enantiomer A and enantiomer B. Enantiomer A has a molecular weight of 126 g/mol, a density of 0.995 g/mL, an optical rotation of = 26o, a melting point of 65 oC, a boiling point of 225 oC, and an odour of citrus fruit. What can you say about the corresponding properties of enantiomer B?
Contributors
-
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)