Introduction
La liaison ionique est le transfert complet d’électron(s) de valence entre atomes. C’est un type de liaison chimique qui génère deux ions de charge opposée. Dans les liaisons ioniques, le métal perd des électrons pour devenir un cation chargé positivement, tandis que le non-métal accepte ces électrons pour devenir un anion chargé négativement. Les liaisons ioniques nécessitent un donneur d’électrons, souvent un métal, et un accepteur d’électrons, un non-métal.
La liaison ionique est observée parce que les métaux ont peu d’électrons dans leurs orbitales les plus externes. En perdant ces électrons, ces métaux peuvent atteindre la configuration de gaz noble et satisfaire la règle de l’octuor. De même, les non-métaux qui ont près de 8 électrons dans leurs coquilles de valence ont tendance à accepter facilement des électrons pour obtenir une configuration de gaz noble. Dans la liaison ionique, plus d’un électron peut être donné ou reçu pour satisfaire à la règle de l’octuor. Les charges de l’anion et du cation correspondent au nombre d’électrons donnés ou reçus. Dans les liaisons ioniques, la charge nette du composé doit être nulle.
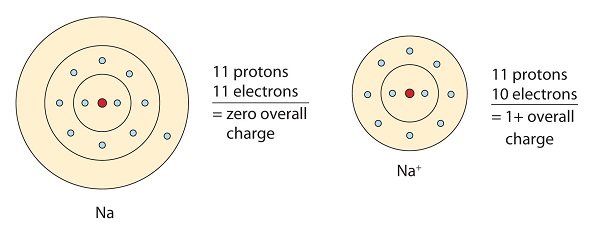
Cette molécule de sodium fait don de l’électron solitaire dans son orbitale de valence afin d’obtenir une configuration en octuor. Cela crée un cation chargé positivement en raison de la perte d’électron.
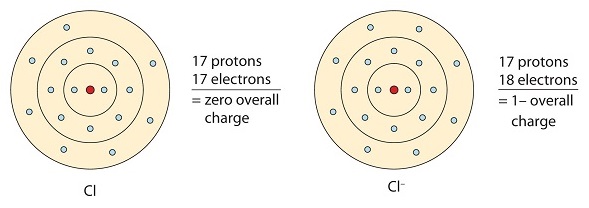
Cet atome de chlore reçoit un électron pour réaliser sa configuration en octet, ce qui crée un anion chargé négativement.
L’énergie globale prédite du processus de liaison ionique, qui comprend l’énergie d’ionisation du métal et l’affinité électronique du non-métal, est généralement positive, ce qui indique que la réaction est endothermique et défavorable. Cependant, cette réaction est très favorable en raison de l’attraction électrostatique entre les particules. À la distance interatomique idéale, l’attraction entre ces particules libère suffisamment d’énergie pour faciliter la réaction. La plupart des composés ioniques ont tendance à se dissocier dans les solvants polaires car ils sont souvent polaires. Ce phénomène est dû aux charges opposées de chaque ion.
Exemple \(\PageIndex{1}\) : Les sels de chlorure
.jpg?revision=2)
Dans cet exemple, l’atome de sodium fait don de son 1 électron de valence à l’atome de chlore. Cela crée un cation sodium et un anion chlore. Remarquez que la charge nette du composé résultant est de 0.
.jpg?revision=2)
Dans cet exemple, l’atome de magnésium fait don de ses deux électrons de valence aux atomes de chlore. Chaque atome de chlore ne peut accepter qu’un seul électron avant d’atteindre sa configuration de gaz noble ; par conséquent, 2 atomes de chlore sont nécessaires pour accepter les 2 électrons donnés par le magnésium. Notice that the net charge of the compound is 0.