1. Aperçu de la signalisation Erk
La voie de la kinase régulée par le signal extracellulaire (ERK) est l’une des principales cassettes de signalisation de la voie de signalisation de la protéine kinase activée par les mitogènes (MAPK). La cascade ERK est activée par une variété d’agents extracellulaires, y compris des facteurs de croissance, des hormones et également des stress cellulaires pour induire des processus cellulaires qui incluent principalement la prolifération et la différenciation, mais dans certaines conditions également la réponse au stress et autres. Les principaux composants de la MAPK/ERK kinase (MEKK) sont les membres de la famille Raf, Raf-1, A-Raf et B-Raf, qui phosphorylent deux résidus de sérine sur les composants de la MAPK/ERK kinase (MEK) MEK1/2. Les ERK1/2 sont responsables de la stimulation des effecteurs en aval, dont beaucoup sont des facteurs de transcription. L’un des principaux facteurs de transcription est la protéine de liaison à l’élément de réponse à l’AMP cyclique (CREB).
Cette voie ERK contribue au contrôle d’un grand nombre de processus cellulaires :
– Régulation de la prolifération cellulaire telle que l’activation des cellules T
– Plasticité synaptique telle que la potentialisation à long terme (LTP).term potentiation (LTP) dans les neurones hippocampiques
– Prolifération des cellules endothéliales pendant l’angiogenèse
– Phosphorylation du facteur de transcription p53
– Le remodelage de la voie de signalisation ERK peut contribuer au développement de la polykystose rénale
– Activation de la phospholipase A2 (PLA2) dans les mastocytes.
2. cascade de signalisation Erk
L’activation de la cascade ERK1/2 est principalement initiée au niveau des récepteurs membranaires, tels que les récepteurs Tyr kinases (RTK), les récepteurs couplés aux protéines G (GPCR), les canaux ioniques et autres. Ces récepteurs transmettent le signal en recrutant des protéines adaptatrices (par exemple, Grb2) et des facteurs d’échange (par exemple, SOS) qui, à leur tour, induisent l’activation de Ras au niveau des membranes plasmiques ou des membranes d’autres organites. Le Ras activé et lié au GTP transmet ensuite le signal en activant les protéines kinases Raf-1, B-Raf et A-Raf (Rafs) au niveau MAP3K de cette cascade. Cette activation se produit en recrutant les Rafs sur les membranes, où ils sont ensuite phosphorylés et activés. La MOS est une autre MAP3K de la cascade ERK, mais elle opère principalement dans le système reproducteur par un mode de régulation distinct. À partir du niveau MAP3K, le signal est ensuite transmis en aval de la cascade par les composants MAPKK : MEK1/2. Ils sont activés par la phosphorylation de la sérine au niveau du motif Ser-Xaa-Ala-Xaa-Ser/Thr typique de MAPKK dans leur boucle d’activation. À leur tour, les MEK1/2 activent leurs seuls substrats connus, les ERK1/2 natifs, qui fonctionnent comme leurs seules cibles en aval, ce qui suggère que les MEK1/2 servent de composants déterminant la spécificité de la cascade ERK1/2. Les MEK1/2 sont les seules protéines kinases à double spécificité qui peuvent phosphoryler les résidus régulateurs Thr et Tyr de ERK1/2. Environ 200 substrats distincts de ERK1/2 ont été identifiés à ce jour. Ce sont des substrats soit dans le cytosol (par exemple, PLA2 RSK), soit lors de la translocation, dans le noyau, notamment des facteurs de transcription tels que Elk1, c-Fos et c-Jun.
– MAP3K-Raf 1
Raf-1 est la plus étudiée des molécules de signalisation des facteurs de croissance au niveau MAP3K de la cascade. C’est une protéine sérine/thréonine kinase de 70 à 75 kDa, qui contient un domaine kinase dans la moitié COOH-terminale de la molécule et un domaine régulateur occupant le reste. Lors de la stimulation par divers mitogènes, Raf-1 subit une activation transitoire dans les 2 à 3 mm. Le mécanisme d’activation du Raf-1 a été largement étudié au cours des dernières années. Il est maintenant clair que Raf-1 est situé en aval de HAS, qui semble interagir directement avec la partie NH2-terminale de Raf-1 lors de la stimulation.
– MAPKK-MEK1/2
Les MEKs constituent une famille de protéines sérine/thréonine kinases conservées au cours de l’évolution qui comprend à ce jour trois isoformes mammifères hautement homologues (85%). Le mécanisme d’activation de MEK-1 implique la phosphorylation de la protéine sur des résidus sérine uniquement et semble être similaire qu’elle soit phosphorylée par MEKK, Raf-1 ou par auto phosphorylation, comme le montrent les cartes de phosphopeptides. Les MAPKK (MEK) sont hautement spécifiques pour les composants en aval ERK-1 et ERK-2. De plus, les MAPKK n’ont pas réussi à reconnaître ni la forme dénaturée de leur substrat ni les peptides contenant les sites de phosphorylation dans ERK, ce qui indique que l’enzyme a besoin de la forme native de MAPK.
– MAPK-ERK-1/2
En raison de leur haut degré de similarité, ERK-1 et ERK-2 sont généralement considérés comme fonctionnellement redondants. Le principal mécanisme en amont conduisant à la phosphorylation de ERK-1 et -2 sur ces deux résidus régulateurs est leur phosphorylation par MEK. En raison de la nature assez large de sa reconnaissance de substrat, les ERK peuvent phosphoryler un grand nombre de protéines après leur activation. Ces protéines sont souvent de nature régulatrice et sont situées à la fois dans le cytoplasme et dans le noyau.
3. Signalisation en aval de la voie Erk
– Prolifération cellulaire
L’ERK1/2 activé phosphoryle RSK et RSK et ERK transloquent tous deux vers le noyau où ils activent de multiples facteurs de transcription tels que CREB, Fos et Elk-1, entraînant finalement la synthèse de protéines effectrices et provoquant des changements dans la prolifération et la survie cellulaires. CREB (protéine de liaison à l’élément de réponse à l’AMPc) est un facteur de transcription cellulaire qui peut multiplier par plus de 10 la transcription des gènes. c-fos est une protéine de 380 acides aminés avec une région de base à fermeture éclair en leucine pour la dimérisation et la liaison à l’ADN et un domaine de transactivation à l’extrémité C-terminale. Elle est impliquée dans des événements cellulaires importants, notamment la prolifération, la différenciation et la survie des cellules. La protéine contenant le domaine ETS (Elk-1) est une protéine qui, chez l’homme, est codée par le gène ELK1. Les fonctions d’Elk-1 sont également celles d’un activateur de transcription.
– Oncogenèse
L’activation d’ERK1/2 favorise la métaplasie et le développement tumoral en phosphorylant Bim et Bid et en provoquant la dégradation de Bim par le protéasome et la séquestration de Bad vers les protéines de liaison à la phosphosérine et, ainsi, en inhibant l’apoptose. Dans une voie distincte, l’activation de ERK1/2 phosphoryle FOXO3a à Ser 294, Ser 344 et Ser 425 et facilite l’interaction FOXO3a-MDM2. Cette interaction renforce la dégradation de FOXO3a par une voie ubiquitine-protéasome dépendante de MDM2, conduisant au développement tumoral.
– Développement et différenciation
La signalisation par les récepteurs tyrosine kinases qui activent la voie Ras/Raf/MAP kinase régule le développement et la différenciation de nombreux types de cellules. Principalement par l’activation des transducteurs de signaux et des activateurs de protéines de transcription (STATs).
– Cycle cellulaire
Cdc25 active les kinases dépendantes des cyclines en retirant le phosphate des résidus du site actif des Cdk. Elle est connue pour contrôler les transitions de la phase G1 à la phase S et de la phase G2 à la phase M. Erk1/2 peut activer la protéine Cdc25 et à son tour promouvoir la progression du cycle cellulaire.
4. Régulation de la signalisation Erk
La régulation de la signalisation Erk est très importante pour nous afin de maintenir la fonction normale des cellules. Il existe une stratégie de régulation multiple pour que la cellule régule la voie de signalisation Erk, principalement la régulation par les boucles de rétroaction, par les échafaudages de flux ascendants et descendants, par la phosphatase et les inhibiteurs de la voie de signalisation Erk.
– Régulation par les boucles de rétroaction
Il existe plusieurs points de rétroaction négative dans la voie ERK (figure 1). MEK est l’une des cibles et peut être inhibée par la phosphorylation par ERK de MEK1/2 à Thr292 et Thr212. La phosphorylation empêche l’augmentation de l’activité de MEK par PAK1 et réduit ainsi l’activation de ERK. La phosphorylation de Raf sur plusieurs sites par ERK fournit un second mécanisme possible de boucle de rétroaction. L’hyperphosphorylation de ces sites empêche l’interaction de Raf avec la GTPase Ras et favorise sa déphosphorylation par la phosphatase PP2A. L’activation ou la régulation transcriptionnelle des phosphatases par ERK constitue un autre mécanisme de rétroaction négative. Ces diverses boucles de rétroaction négative activées par ERK constituent un moyen de limiter la durée du signal et de ramener la voie à l’état basal.
– Régulation des échafaudages en amont et en aval
Les protéines d’échafaudage lient deux ou plusieurs composants d’une voie de signalisation pour les rapprocher et faciliter ainsi leur interaction fonctionnelle. En outre, les échafaudages peuvent cibler ces modules de signalisation multi-enzymes vers différents emplacements cellulaires et ainsi renforcer la phosphorylation d’un sous-ensemble spécifique de substrats en aval. Les échafaudages affectent également la durée du signal, empêchent la diaphonie entre des voies similaires et peuvent lier l’activation du module de signalisation à un signal activateur spécifique en amont.
– Phosphatase et inhibiteurs
L’activité des voies MAPK est déterminée par les actions concurrentes des kinases en amont et des phosphatases inhibitrices. Les voies MAPK sont interrompues par la déphosphorylation de leurs composants par plusieurs phosphatases. Plusieurs sérine/thréonine phosphatases, telles que PP2A et PP2Ca, et tyrosine phosphatases, telles que PTP-SL et HePTP, ont été montrées pour inactiver les MAPK.
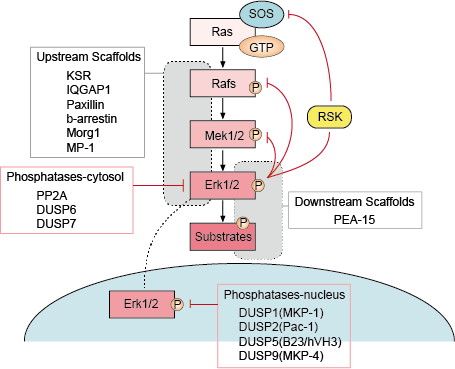
Figure 1. Régulation de la voie de signalisation Erk
5. Relation avec les maladies
Concordant avec leurs rôles critiques dans les activités cellulaires clés, y compris la prolifération, la différenciation et la survie ou la mort des cellules, les voies de signalisation MAPK ont été impliquées dans la pathogenèse de nombreuses maladies humaines.
– La maladie d’Alzheimer
La maladie d’Alzheimer (MA) est une maladie neurodégénérative caractérisée par un dysfonctionnement cognitif et de la mémoire qui résulterait de la formation dans le cerveau à la fois de plaques séniles contenant de l’amyloïde-β (Aβ) et d’enchevêtrements neurofibrillaires contenant la protéine tau associée aux microtubules. Des données suggèrent donc que les voies de signalisation MAPK pourraient contribuer à la pathogenèse de la MA par la régulation de l’apoptose neuronale, de l’activité β- et γ-sécrétase et de la phosphorylation de l’APP et de tau.
– Maladie de Parkinson
La maladie de Parkinson (MP) est la deuxième maladie neurodégénérative la plus répandue. Diverses observations suggèrent que les voies de signalisation MAPK contribuent aux réponses neuroinflammatoires et à la mort neuronale déclenchées par les agrégats d’α-synucléine ou les déficiences fonctionnelles de la parkine ou du DJ-1 dans la pathogenèse de la maladie de Parkinson.
– La signalisation MAPK dans le cancer
Plusieurs des mutations associées au cancer des composants des voies de signalisation MAPK ont été trouvées dans Ras et B-Raf, qui participent tous deux à la voie de signalisation ERK. La voie de signalisation ERK joue un rôle dans plusieurs étapes du développement tumoral. La phosphorylation par ERK de protéines telles que la kinase de la chaîne légère de myosine, la calpaïne, la kinase d’adhésion focale et la paxilline favorise la migration des cellules cancéreuses. De plus, la signalisation ERK1/2 régule les activités et les niveaux des protéines de la famille Bcl-2 telles que la protéine pro-apoptotique BIM et la protéine anti-apoptotique MCL-1, favorisant ainsi la survie des cellules cancéreuses.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |