


Table des matières
Pathophysiologie des SOPK
Critères diagnostiques
Résistance à l’insuline et résistance à la leptine
Auteurs
Beaucoup d’entre nous ne réalisent pas à quel point le système complexe de boucles de rétroaction de notre système endocrinien reproducteur fonctionne bien jusqu’à ce qu’il soit perturbé d’une manière ou d’une autre. Le syndrome des ovaires polykystiques (SOPK) en est un exemple. Il s’agit d’un trouble caractérisé par un ensemble de symptômes. Il est prévalent chez les patients qui se présentent dans les cliniques d’infertilité et touche 5 à 10 % des femmes en âge de procréer. On estime que 90 % des cas d’anovulation sont liés au SOPK. En plus d’affecter négativement les paramètres métaboliques et l’ovulation, le SOPK est également associé à plusieurs problèmes de santé mentale (tels que la dépression et l’anxiété) chez les femmes qui en sont atteintes. Dans la première partie, nous aborderons la pathophysiologie du SOPK, ses critères de diagnostic et la résistance à l’insuline et à la leptine. Dans la deuxième partie, nous aborderons la prise en charge du SOPK, les implications psychologiques et le rôle unique du clinicien dans l’accompagnement de la patiente atteinte de SOPK.
Pathophysiologie du SOPK
Chez les femmes ovulatoires, sous l’influence d’un axe hypothalamo-hypophyso-ovarien (HPO) fonctionnant correctement, le cycle menstruel est caractérisé par la croissance et le développement (généralement) d’un seul follicule extrait de la cohorte (groupe de follicules) du mois en cours. En réponse à la stimulation de la GnRH, l’hypophyse antérieure sécrète deux gonadotrophines importantes : l’hormone folliculo-stimulante (FSH) et l’hormone lutéinisante (LH). La FSH agit sur l’ovaire pour favoriser la croissance et la maturation de petits follicules. Le follicule dominant de ce mois est celui qui a acquis le plus de récepteurs FSH. Ce follicule va continuer à croître et à mûrir au détriment des autres petits follicules, qui sont ensuite réabsorbés par l’organisme (mais sont toujours déduits de la réserve totale d’ovules de la femme). La croissance du follicule dominant génère une production d’œstradiol et des niveaux élevés d’œstrogènes signalent à la production de FSH de cesser via un système de rétroaction négative, mais un niveau élevé et soutenu d’œstrogènes déclenchera une poussée ponctuelle de LH qui provoque l’ovulation.
Chez une femme atteinte de SOPK, l’axe HPO n’exprime pas une fonctionnalité normale. L’hormone pulsatile GnRH est altérée, ce qui entraîne une augmentation de l’activité de la LH par l’hypophyse. Cette augmentation de la LH accroît la stimulation des cellules thèques (voir Fig 1), qui produisent de l’androstènedione et de la testostérone, deux androgènes, et le milieu hyperandrogène de l’ovaire qui en résulte empêche la croissance, la maturation et l’ovulation normales des follicules. L’ovaire se compose alors de nombreux petits follicules antraux qui ne deviennent jamais dominants. L’accumulation de ces follicules peut entraîner une augmentation de la taille des ovaires et générer un taux sérique basal d’œstrogènes légèrement élevé. On ne sait toujours pas pourquoi le SOPK survient et qui il affecte, mais on pense que la génétique et les facteurs environnementaux ont une interaction complexe dans son émergence et ses manifestations cliniques.
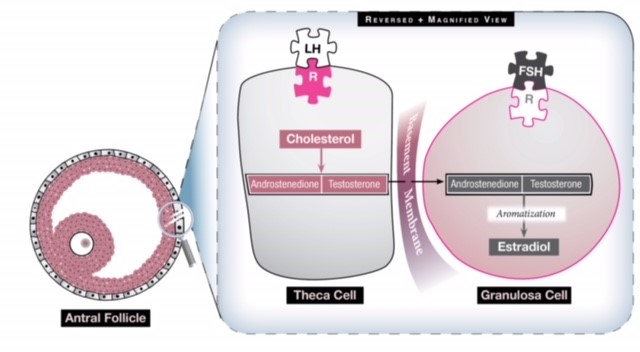
Fig 1 : Il y a deux cellules dans l’ovaire qui contribuent à la production d’œstrogènes et elles travaillent en synergie. La cellule thèque convertit le cholestérol en deux androgènes (androstènedione et testostérone) sous l’influence de la LH. Ces androgènes traversent ensuite la membrane basale pour atteindre la cellule de la granulosa qui, sous l’influence de la FSH, les transforme en œstrogènes par un processus appelé aromatisation. Une stimulation excessive de la LH va donc générer plus d’androgènes qu’il n’est possible d’en convertir en œstrogènes, de sorte que le taux d’œstrogènes ne devient jamais assez élevé pour générer une poussée de LH et que l’ovaire présente un milieu hyperandrogène.
Critères diagnostiques
Le SOPK n’est pas défini ou diagnostiqué par un simple symptôme et constitue souvent un diagnostic d’exclusion pour les femmes qui présentent une oligo-ovulation et des signes d’hyperandrogénie (tels que l’alopécie acnéique et l’hirsutisme (croissance et texture des poils de type masculin) une fois que d’autres troubles sont exclus. Elle affecte les femmes de toutes formes, tailles et origines. Bien que les symptômes puissent commencer dès la ménarche, la plupart des cliniciens hésitent à diagnostiquer un SOPK chez une adolescente ayant ses règles depuis peu, car l’irrégularité du cycle menstruel est normale au cours de la première année suivant la ménarche et peut se résorber avec le temps. Les critères de diagnostic les plus couramment utilisés aujourd’hui ont été révisés lors d’un atelier international d’experts qui s’est tenu à Rotterdam, aux Pays-Bas, en 2003 et sont appelés les critères de Rotterdam : Le SOPK ne peut être diagnostiqué que lorsqu’une patiente présente au moins deux des trois caractéristiques suivantes : oligo/anovulation, hyperandrogénie (biochimique ou clinique) et apparition d’ovaires polykystiques à l’échographie.L’hyperandrogénie est diagnostiquée soit cliniquement (par le clinicien qui observe des symptômes androgéniques), soit biochimiquement (comme des niveaux élevés de testostérone libre sérique).
Ces critères ont été révisés en 2018 par un comité international qui a apporté quelques changements. Tout d’abord, en raison de la disponibilité d’appareils d’échographie transvaginale sensibles, la morphologie des ovaires polykystiques (PCOM) est caractérisée par la présence de 20 follicules ou plus (<10 mm) dans l’un ou l’autre des ovaires ou un volume ovarien ≥ 10 mlsur l’un ou l’autre des ovaires, tel qu’observé par échographie transvaginale, souvent situé autour de la périphérie de l’ovaire (ou des ovaires). Les lignes directrices de 2018 indiquent également que siune femme a des cycles menstruels irréguliers et une hyperandrogénie, l’échographie n’est pas nécessaire au diagnostic, bien que de nombreux cliniciens préfèrent encore la réaliser. Les taux d’hormone antimüllérienne (AMH) sont souvent élevés chez les patientes atteintes de SOPK, bien que cela ne soit pas spécifique au SOPK, car des taux élevés peuvent être trouvés chez des femmes sans cette affection. Chez les femmes affectées par le SOPK, un taux élevé d’AMH reflète un nombre plus élevé de folliculesarrêtés aux stades pré-antraux et antraux qui ne parviennent pas à ovuler.
Il faut d’abord écarter les autres affections susceptibles de provoquer des cycles menstruels irréguliers (grossesse, hypo- et hyperthyroïdie, insuffisance ovarienne et hyperprolactinémie) et l’hyperandrogénie (hyperplasie congénitale des surrénales, tumeur surrénalienne et tumeur sécrétant des androgènes), Ainsi, en plus des taux sériques de bHCG, les taux basaux de FSH et de LH, l’hormone thyréostimulante (TSH), la prolactine, la testostérone totale et libre, la 17hydroxyprogestérone (17OHP), le sulfate de déhydroépiandrostérone (DHEAS) sont prélevés. L’un des diagnostics différentiels les plus difficiles est de distinguer une femme souffrant d’aménorrhée fonctionnelle hypothalamique (FHA) d’une femme maigre souffrant de SOPK. Classiquement, les femmes souffrant d’aménorrhée fonctionnelle hypothalamique ont un IMC bas, mais il peut aussi se situer dans la fourchette basse/normale. Les deux conditions sont caractérisées par une anovulation et des ovaires qui semblent avoir de nombreux petits follicules au repos. Bien que l’hyperandrogénie ne soit pas une composante de la FHA, les femmes atteintes de cette maladie peuvent présenter un hirsutisme en raison de leur origine ethnique, ce qui rend le tableau clinique encore plus confus. Les analyses de sang et les échographies permettent de distinguer le FHA du PCOS. Les femmes atteintes de FHA présentent souvent des taux basaux de FSH et de LH faibles ou normaux (en raison d’une hypo-stimulation des ovaires) et un faible taux d’œstrogènes, alors que les femmes atteintes de SOPK présentent généralement des taux sériques de LH élevés et des taux de FSH faibles ou normaux. À l’échographie, l’utérus et les ovaires des femmes atteintes de FHA sont petits oupetits/normaux, alors que les femmes atteintes de SOPK présentent généralement un volume ovarien accru (>10 ml).Des recherches émergentes portent sur un lien possible entre FHA et SOPK, car toutes les femmes ne présentent pas les caractéristiques de l’une ou l’autre de ces affections, et le FHA et le SOPK présentent certaines caractéristiques qui se chevauchent.
Résistance à l’insuline et résistance à la leptine
Bien que le diagnostic de résistance à l’insuline (RI) ne fasse pas partie des critères de Rotterdam, il est fortement prévalent chez les femmes atteintes de SOPK. Un IMC élevé augmente la probabilité qu’une femme atteinte du SOPK présente une IR, mais même les femmes non obèses atteintes du SOPK sont beaucoup plus susceptibles de développer une résistance à l’insuline que leurs homologues de taille comparable sans SOPK. Outre les conséquences de l’IR sur la santé (telles que le syndrome métabolique et le diabète sucré de type 2), elle exacerbe et contribue à l’hyperandrogénie dans une population de patients qui en souffre déjà.
La norme d’or pour diagnostiquer l’insulinorésistance consiste à utiliser un clamp euglycémique hyperinsulinémique, atest qui doit être réalisé en milieu hospitalier. Pour la plupart, cela n’est pas raisonnable, c’est pourquoi on procède à des tests indirects de l’IR. Chez les femmes atteintes du SOPK dans un contexte clinique de préconception, il est suggéré d’effectuer une épreuve d’hyperglycémie provoquée par voie orale (HGPO) étant donné le risque élevé pour les femmes atteintes du SOPK de développer une intolérance au glucose et un diabète gestationnel pendant la grossesse. Bien qu’il prenne un peu de temps, ce test est préférable à la glycémie plasmatique à jeun et aux niveaux d’insuline seuls, car il peut diagnostiquer une intolérance au glucose à un stade plus précoce.Chez les femmes atteintes de SOPK qui ne font pas partie d’une catégorie à haut risque (c’est-à-dire, IMC<25 kg/m2,qui n’essaient pas de concevoir, qui n’ont pas d’antécédents personnels ou familiaux d’intolérance au glucose), l’obtention d’au moins des taux de base de glycémie à jeun, d’insuline et d’hémoglobineA1c peut être utile afin d’obtenir un » instantané » du statut glycémique de cette patiente.
Lorsqu’une femme est atteinte de SOPK, le surpoids ou l’obésité intensifie les conséquences métaboliques. Les adipocytes blancs sont métaboliquement actifs. À un niveau normal, ils ont un rôle protecteur car ils offrent un abri sûr aux lipides et empêchent la graisse d’entrer dans les organes. Lorsqu’il y a trop de cellules graisseuses, elles peuvent être surchargées et éclater, libérant des acides gras dans la circulation sanguine, ce qui peut affecter tous les organes. Ces cellules graisseuses se « coincent » entre les cellules des organes et les rendent rigides, endommagées, moins fonctionnelles et provoquent une inflammation chronique. Il n’est pas rare de diagnostiquer une « stéatose hépatique » chez une femme obèse souffrant de SOPK, car le foie est particulièrement vulnérable. En outre, un excès d’adiposité peut perpétuer l’hyperinsulinémie et la résistance à l’insuline existantes en perturbant l’équilibre délicat des cytokines et des hormones produites par le tissu adipeux (voir figure 2), par exemple en diminuant la production de cytokines qui augmentent la sensibilité à l’insuline et en augmentant celles qui favorisent l’inflammation et la résistance à l’insuline. L’excès d’insuline contribue en outre à l’adiposité abdominale et à l’hyperandrogénie, créant un cercle vicieux chez les patientes atteintes de SOPK qui peut être difficile à surmonter.
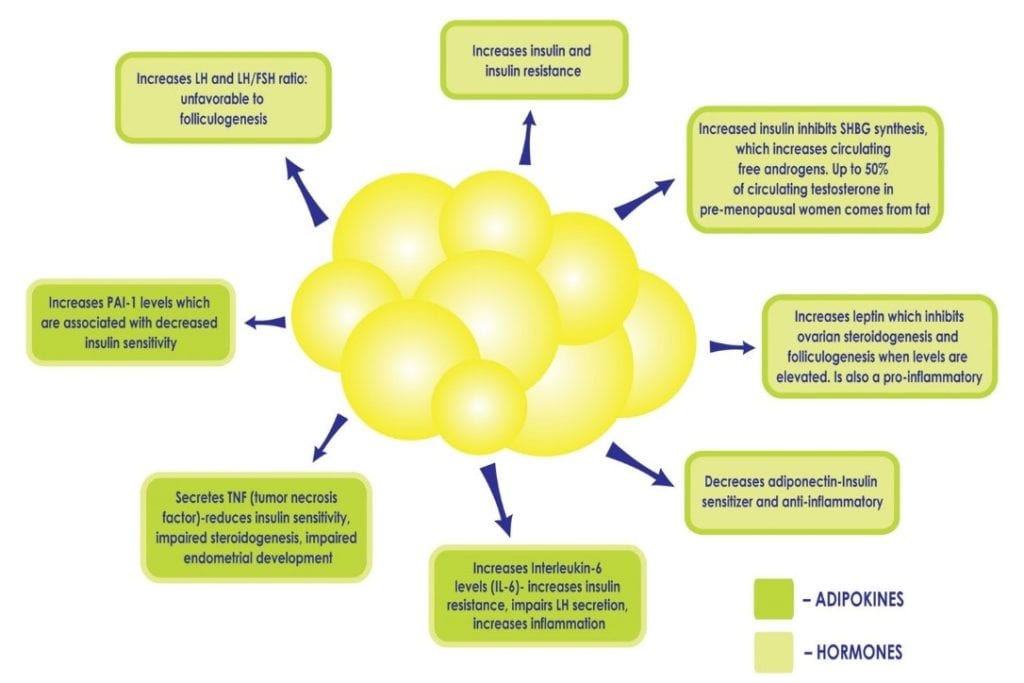
Figure 2 : L’augmentation de l’adiposité, et l’augmentation subséquente des cellules graisseuses, peut perpétuer l’hyperinsulinémie et la résistance à l’insuline en perturbant l’équilibre délicat des hormones produites par le tissu adipeux, comme la diminution de la production d’adiponectine, une cytokine qui augmente la sensibilité à l’insuline et l’augmentation d’autres qui favorisent l’inflammation.
En plus de la résistance à l’insuline, les patients atteints de SOPK et d’obésité peuvent également souffrir de ce que certains appellent la résistance à la leptine. Certaines études ont montré que les taux de leptine sont plus élevés chez les patientes obèses atteintes du SOPK que chez les patientes maigres. La leptine est une protéine produite par le tissu adipeux qui régule l’équilibre énergétique et l’appétit de l’organisme. Lorsqu’elle fonctionne correctement, une augmentation de la leptine signale au cerveau de réduire l’appétit d’une personne et une diminution de la leptine fait l’inverse, elle signale au cerveau d’augmenter l’appétit pour fournir le carburant nécessaire à l’énergie. Cependant, chez de nombreux patients atteints de SOPK et souffrant d’obésité, ce système est défectueux et, malgré une augmentation des concentrations de leptine secondaire à l’augmentation du tissu adipeux, l’efficacité de la leptine diminue, ce qui entraîne une résistance à la leptine. La résistance à la leptine est considérée comme un facteur de risque important dans la pathogenèse du surpoids et de l’obésité, car l’organisme reste insensible à des concentrations élevées et signale à la femme qu’elle a encore faim/non rassasiée même après avoir mangé. De nombreuses femmes atteintes de SOPK se plaignent de ne jamais se sentir rassasiées en raison de cette résistance et continuent à manger, ce qui entraîne une augmentation du tissu adipeux, laquelle se traduit par une résistance accrue à la leptine et perpétue ce cycle néfaste. Par conséquent, les conditions de surpoids et d’obésité sont courantes chez les femmes atteintes de SOPK et la perte de poids peut sembler impossible puisque l’alimentation intuitive n’est pas efficace lorsque les signaux de faim et de satiété ne sont pas fiables.
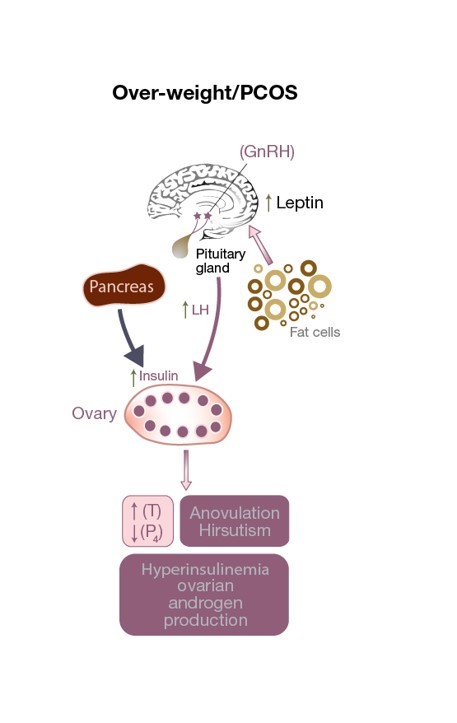
Figure 3 : perturbation de l’axe HPO chez une patiente atteinte de SOPK. Il y a une stimulation excessive de la LH sur la cellule thèque, ce qui entraîne une augmentation des niveaux de testostérone, un environnement ovarien androgène et une anovulation (entraînant de faibles niveaux de progestérone). L’augmentation des taux de leptine due à un excès de cellules adipeuses affecte la sécrétion de GnRH. Des niveaux élevés d’insuline contribuent à l’hyperandrogénie.
L’altération de la sécrétion de leptine n’affecte pas seulement le poids corporel mais peut avoir un effet néfaste sur l’ovulation (voir Fig 3)et même sur la fécondation chez les patientes SOPK de poids normal. Elle altère la libération de GnRH par l’hypothalamus, diminuant la stimulation de l’hypophyse antérieure (et donc la sécrétion de FSH et de LH), et empêchant le développement d’un ovocyte mature. En outre, les granulosaccharides stockent et produisent également de la leptine, et des niveaux élevés de leptine diminuent leur capacité d’aromatisation, ce qui, en fin de compte, interfère avec la capacité d’un follicule dominant à produire des quantités adéquates d’œstrogènes (voir Fig 1). Une petite étude d’observation a trouvé une corrélation directe entre la concentration de leptine trouvée dans le fluide folliculaire (FF-leptine) (qui a été corrélée avec le taux de fécondation) chez les femmes maigres atteintes de SOPK qui ont subi une FIV, par rapport aux femmes appariées de poids normal qui ovulent normalement.
Auteurs
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Sincères remerciements à NeilChappell, MD, pour son aide à la rédaction de cet article.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter »



![]()