US Pharm. 2016;41(12):HS16-HS19.
ABSTRACT : La marijuana, ou cannabis, est communément considérée comme une substance bénigne sans effets indésirables ; cependant, le syndrome d’hyperémèse cannabinoïde (SHC) est une séquelle de la consommation chronique de cannabis. Les cliniciens doivent fortement suspecter le SHC chez les consommateurs de cannabis à long terme qui présentent des nausées et des vomissements irréductibles et dont les symptômes sont soulagés par un bain d’eau chaude. L’absence de réponse aux antiémétiques devrait aider à diagnostiquer le SHC. Le seul traitement permettant de résoudre le SHC est l’abstinence de cannabis, bien que l’halopéridol soit étudié comme une option thérapeutique potentielle. Il convient de conseiller à un patient souffrant du SHC d’éviter le cannabis, car la poursuite de sa consommation déclenchera d’autres symptômes.
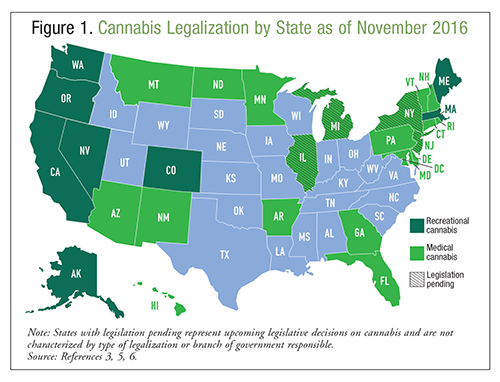
La marijuana, ou cannabis, est un produit naturel dérivé d’une plante de chanvre connue sous le nom de Cannabis sativa ; elle est communément considérée comme une substance bénigne sans effets indésirables.1 Le cannabis peut être fumé, vaporisé ou ingéré à des fins d’intoxication ou de bénéfice thérapeutique, et il est utilisé depuis des siècles à ces fins. Selon l’enquête nationale sur la consommation de drogues et la santé de 2014, >22 millions d’Américains ont consommé du cannabis au cours du mois précédent, ce qui fait de cette substance la drogue illicite la plus utilisée.2 On s’attend à ce que la consommation de cannabis aux États-Unis continue de croître en raison de l’augmentation des taux de légalisation3. Selon l’enquête épidémiologique nationale sur l’alcool et les conditions connexes, les résidents des États qui ont légalisé le cannabis médical sont deux fois plus susceptibles d’approuver la consommation de cannabis que les résidents des États sans légalisation.4 Actuellement, le cannabis peut être utilisé à des fins médicinales dans 28 États, et il peut également être utilisé à des fins récréatives dans huit d’entre eux. La FIGURE 1 donne des informations sur la légalité du cannabis dans l’ensemble des États-Unis à l’heure actuelle.3,5,6 Outre la légalisation, 21 États et le District de Columbia ont décriminalisé la possession de petites quantités de cannabis. Les urgences médicales liées à la consommation de cannabis ont augmenté de 29 % entre 2009 et 2011 ; on ignore si cette augmentation est due à la puissance du cannabis, à une légalisation accrue ou à d’autres facteurs1.
Le corps humain possède un système cannabinoïde intrinsèque, connu sous le nom de système endocannabinoïde, qui contient des neurotransmetteurs (c’est-à-dire l’anandamide) qui régulent l’appétit, le sommeil, la douleur, les émotions et le mouvement.7,8 Le terme cannabinoïde désigne tout composé qui affecte les récepteurs cannabinoïdes dans le corps. Les récepteurs qui servent à des fins thérapeutiques comprennent les cannabinoïdes de types 1 et 2 (CB1, CB2). Les CB1 sont présents en grande quantité dans le cerveau et en moindre quantité dans les tissus nerveux spinaux et périphériques, tandis que les CB2 sont présents en grande quantité dans les tissus périphériques et le système immunitaire.8
Le cannabis contient >100 substances chimiques, dont le delta-9-tétrahydrocannabinol (THC) est le composé le plus actif. Parce qu’il se lie à CB1, le THC est responsable de l’effet intoxicant du cannabis.1 Les autres cannabinoïdes présents dans le cannabis comprennent le cannabidiol et le cannabigérol, qui ne sont pas psychoactifs. En raison du large éventail d’activités que le système intrinsèque affecte, de nombreuses personnes ont utilisé les cannabinoïdes pour s’intoxiquer et à des fins thérapeutiques.
Syndrome d’hyperémèse cannabinoïde
Le cannabis a été utilisé pour favoriser l’appétit dans le traitement de l’anorexie et de la cachexie associées au VIH/sida et pour soulager les nausées et les vomissements induits par la chimiothérapie. Bien que le cannabis puisse être utilisé pour traiter les nausées et les vomissements, il peut également provoquer un syndrome paradoxal de nausées et de vomissements connu sous le nom de syndrome d’hyperémèse cannabinoïde (SHC). Le SHC est un diagnostic clinique caractérisé par l’usage chronique de cannabis.9 Une caractéristique unique du SHC est la nausée et les vomissements cycliques qui peuvent ne pas répondre à la thérapie antiémétique standard, mais qui répondent aux bains chauds compulsifs.3,9 Le premier rapport de cas documentant le SHC (2004) décrit neuf patients en Australie. La consommation chronique de cannabis avait eu lieu avant la présentation, et les symptômes comprenaient des nausées et des vomissements. La plupart des patients ont déclaré qu’ils se baignaient dans de l’eau chaude pour soulager les symptômes. L’arrêt de la consommation de cannabis a conduit à la résolution de la maladie, tandis que les patients qui ont continué à consommer du cannabis sont restés malades.10 Depuis lors, d’autres rapports de cas et séries ont été publiés qui décrivent plus en détail le SHC ; cependant, aucune étude randomisée et contrôlée ne l’a évalué ou défini.
Au Colorado, les taux de SHC ont doublé depuis 2009, lorsque le cannabis y a été légalisé.3 Cependant, il est important de noter que le SHC est souvent non reconnu par les cliniciens, ce qui peut conduire à un bilan de patient étendu et coûteux. Le diagnostic peut être difficile, et le SHC peut être diagnostiqué à tort comme de nombreux autres troubles, notamment le syndrome des vomissements cycliques (SVC). Bien que certains patients qui consomment de la marijuana présentent un CVS, il existe plusieurs facteurs de différenciation entre le CVS et le SHC. Le SVC implique généralement des antécédents personnels ou familiaux de migraines, des antécédents de troubles psychiatriques et l’absence de bains chauds compulsifs.11 Les patients atteints du SHC se présentent souvent au service des urgences (SU) en raison de leurs symptômes. Un rapport de cas rédigé par Soriano-Co et ses collègues a démontré que les patients diagnostiqués comme souffrant du SHC étaient plus susceptibles de consulter fréquemment un clinicien, de se rendre aux urgences et d’être hospitalisés.12 En moyenne, un patient a consulté cinq fois un clinicien, s’est rendu sept fois aux urgences et a été hospitalisé trois fois avant que le diagnostic ne soit posé, ce qui indique que les patients souffrant du SHC peuvent être vus dans n’importe quel établissement de soins.12 L’utilisation de cannabinoïdes synthétiques, comme le K2, alias Spice, qui ne peut pas être détecté par les tests de dépistage de drogues dans l’urine, complique encore le diagnostic.13 Le SHC doit être différencié des autres troubles qui provoquent des nausées et des vomissements, et le diagnostic est généralement un diagnostic d’exclusion.
Pathophysiologie
Il existe de multiples hypothèses concernant la physiopathologie du SHC ; cependant, en raison de la multitude de substances chimiques actives dans le cannabis et de l’existence de divers sites d’action, le processus physiopathologique définitif est inconnu. En outre, tous les consommateurs de cannabis ne développent pas le SHC, ce qui rend encore plus difficile la description du syndrome.
À faibles doses, le THC est connu pour exercer un effet antiémétique, mais en cas de consommation importante et chronique de cannabis, on observe le contraire. Il a été suggéré que le THC s’accumule avec le temps en raison de son grand volume de distribution. Le THC peut activer directement les récepteurs CB1 du système nerveux entérique et réduire la motilité gastrique, ce qui augmente le risque de nausées et de vomissements en cas d’activation excessive.9 On suppose que les cannabinoïdes synthétiques, qui imitent à la fois l’effet et la structure du THC, provoquent une surstimulation des récepteurs CB1 en raison de leurs puissants effets agonistes.14 Ces récepteurs CB1 sont également présents dans l’hypothalamus et peuvent provoquer des vomissements en altérant la thermorégulation, ce qui conduit au soulagement potentiel des symptômes par des bains chauds.9,11
Facteurs de risque, évolution clinique et diagnostic
L’usage chronique de cannabis est le principal facteur de risque de développement du SHC. Le risque de SHC pour un patient augmente avec une consommation prolongée de cannabis.9 La consommation quotidienne de cannabis semble être plus susceptible de provoquer un SHC qu’une consommation moins fréquente ; cependant, toute quantité de cannabis peut entraîner un SHC.15
Le SHC comporte plusieurs phases, qui ont été classées comme préémétique, hyperémétique et de récupération.9,16 La phase préémétique, qui peut durer des mois à des années, est caractérisée par des nausées, la peur de vomir et un inconfort abdominal. Il est fréquent que les consommateurs de cannabis augmentent leur consommation de cannabis pendant la phase préémétique afin d’atténuer les nausées.11 Pendant la phase hyperémétique, qui dure généralement de 24 à 48 heures, le patient souffre de nausées et de vomissements fréquents et graves. Cela peut conduire à une perte de poids et à une déshydratation aiguë, pouvant entraîner une insuffisance prérénale.17,18 La persistance des nausées et des vomissements peut entraîner le développement d’anomalies électrolytiques.
Pour soulager les symptômes, les patients peuvent commencer à prendre des bains chauds, c’est-à-dire rester dans un bain ou une douche chaude pendant des heures.11 Il s’agit d’un comportement auto-appris qui devient compulsif une fois que le patient réalise les avantages. Les bains chauds peuvent contribuer à la thermorégulation et à la réduction du flux sanguin vers l’estomac en agissant sur la vasodilatation périphérique et la redistribution de la circulation splanchnique, ce qui entraîne une diminution des vomissements.11 Malheureusement, les bains chauds peuvent augmenter le risque de déshydratation et d’insuffisance rénale aiguë.17 Les bains chauds doivent être considérés comme une caractéristique pathognomonique, car ils ne sont pas observés dans d’autres pathologies qui peuvent avoir une présentation similaire. Les patients interrompent généralement les bains chauds lorsque les symptômes ne sont pas présents et les reprennent une fois que les nausées et les vomissements réapparaissent après une future consommation de cannabis.
De nombreux patients cherchent à obtenir des soins médicaux pour leurs symptômes pendant la phase hyperémétique. Par conséquent, les patients peuvent subir des bilans négatifs approfondis pour diverses autres affections, comme le SVC, la pancréatite et la gastroparésie, qui peuvent imiter certains symptômes du SHC. Une fois les nausées et les vomissements disparus, généralement dans les 48 heures, le patient entre dans la phase de récupération. Le rétablissement peut durer de quelques jours à quelques mois et est associé à l’arrêt de la consommation de cannabis. Si le patient recommence à consommer du cannabis, les symptômes réapparaissent généralement.11
Il est important de prendre en compte l’impact du SHC sur les autres états pathologiques d’un patient. Il existe des rapports de cas de patients atteints de SHC qui ont développé des problèmes médicaux liés à la SHC autres que l’insuffisance rénale. Grégoire et ses collègues ont décrit un patient ayant des antécédents de manie bipolaire et de consommation de cannabis qui a développé une SHC.19 Le patient a attribué les vomissements intraitables au lithium et a cessé de prendre le lithium, et un épisode maniaque est survenu. La réinitialisation du lithium à l’hôpital n’a déclenché aucun autre vomissement, indiquant que le cannabis était la cause probable.19
Des critères diagnostiques du SHC ont été proposés. La consommation de cannabis à long terme est essentielle pour le diagnostic. Le temps nécessaire pour développer le SHC varie ; cependant, la plupart des patients se présentent 1 à 5 ans après une consommation chronique de cannabis. La présentation de symptômes similaires à ceux du SHC avant un an d’utilisation chronique de cannabis ne doit pas empêcher le diagnostic. Les principales caractéristiques du SHC sont les suivantes : nausées et vomissements cycliques sévères, résolution des symptômes à l’arrêt du cannabis, soulagement obtenu par un bain d’eau chaude, douleurs abdominales épigastriques ou péri-ombilicales, et consommation hebdomadaire de cannabis. Les éléments favorables au diagnostic de SHC sont l’âge <50 ans, la perte de poids >5 kg, l’apparition des symptômes le matin, des habitudes intestinales normales et des résultats normaux aux autres bilans15. Le TABLEAU 1 résume les résultats courants à l’appui d’un diagnostic de SHC.14

Traitements potentiels
Les soins de soutien sont indiqués pour tous les patients qui se présentent dans la phase hyperémétique du SHC. Si le patient peut le tolérer, la prise orale de liquides est recommandée pour l’hydratation. Certains patients ne peuvent pas tolérer l’hydratation orale en raison de vomissements excessifs, de sorte que les fluides IV peuvent être indiqués pour la déplétion volumique associée à la déshydratation.11 Comme des perturbations électrolytiques peuvent se produire avec les vomissements, la surveillance et le remplacement des électrolytes sont indiqués.
Les bains chauds compulsifs sont un comportement appris caractéristique que les patients peuvent utiliser pour minimiser les symptômes associés au SHC. Comme cela a été discuté précédemment, le bain chaud peut aider à la thermorégulation. Une autre théorie est que la vasodilatation périphérique et la redistribution de la circulation splanchnique peuvent réduire le flux sanguin vers l’estomac, entraînant une diminution des vomissements.11 Un seul rapport de cas a indiqué que l’atténuation des symptômes par les bains chauds peut s’estomper avec le temps ; cependant, ce phénomène semble peu fréquent.20
Les antiémétiques ont été utilisés sans succès pour soulager les symptômes du SHC. L’absence de réponse aux antiémétiques doit amener le clinicien à suspecter un SHC. Dans des rapports de cas, des patients n’ont eu aucun soulagement thérapeutique des nausées et des vomissements avec l’ondansétron, la prométhazine, la chlorpromazine ou le métoclopramide.21 Dans une petite série de cas, 87,5 % des patients n’ont pas répondu au traitement antiémétique standard.12
L’halopéridol exerce des effets antipsychotiques en antagonisant les récepteurs D2 de la dopamine dans les voies mésolimbiques et mésocorticales. L’halopéridol est traditionnellement utilisé pour traiter l’agitation ; cependant, il a été utilisé avec succès comme antiémétique en chirurgie générale et en oncologie. Les récepteurs D2 sont également présents dans la zone de déclenchement des chimiorécepteurs, ce qui pourrait expliquer ces propriétés antiémétiques. Des études animales suggèrent que le CB1 peut être affecté par l’halopéridol, faisant de cet agent une option thérapeutique potentielle.22,23 Witsil et Mycyk ont évalué rétrospectivement cette hypothèse chez quatre patients souffrant de nausées et de vomissements réfractaires au traitement antiémétique standard.21 Tous les patients ont été soulagés dans les 1 à 2 heures suivant l’administration d’halopéridol 5 mg par voie IV.21,24 Cette petite étude de cas démontre que l’halopéridol peut soulager suffisamment les nausées et les vomissements liés à la SCH pour éviter l’admission à l’hôpital, ce qui peut entraîner des économies pour le système de santé.19 Le risque d’allongement de l’intervalle QTc avec l’halopéridol doit être pris en compte, en particulier chez les patients présentant des troubles électrolytiques à la suite de vomissements excessifs. Des études supplémentaires sont justifiées pour déterminer la place de l’halopéridol dans le traitement et sa posologie optimale.
L’arrêt du cannabis est le seul traitement qui soulage et prévient les symptômes associés au SHC. Dans l’étude qui a décrit pour la première fois le SHC, l’abstinence de cannabis a entraîné l’arrêt des nausées et des vomissements chez sept des dix patients, tandis que les autres ont continué à souffrir de la maladie de manière continue. Trois des sept patients ont par la suite recommencé à consommer du cannabis, et les symptômes sont réapparus quelques mois plus tard.10 Ces résultats ont été reproduits dans des rapports de cas récents.12,25 Les patients devraient être informés sur l’arrêt du cannabis pour soulager les symptômes, et des ressources pour aider à l’arrêt devraient être fournies.
Conclusion
A mesure que le cannabis est légalisé dans plus d’États, il est probable que sa consommation augmente et que davantage de cas de SHC soient signalés. Les cliniciens devraient soupçonner un SHC chez les patients qui se présentent avec des antécédents de consommation de cannabis ou de cannabinoïdes synthétiques et des symptômes comprenant des nausées et des vomissements irréductibles, ainsi que des rapports sur l’utilisation de bains chauds pour contrôler les symptômes. Cette conjecture pourrait permettre d’éviter des bilans importants et coûteux pour d’autres pathologies. Les pharmaciens ont un rôle à jouer en conseillant les patients sur les risques associés à la consommation de cannabis et en orientant les patients présentant des symptômes de la SCH vers des soins de suivi appropriés. Des rapports de cas dans la littérature ont identifié les facteurs de risque du SHC. Malheureusement, le SHC est relativement peu signalé, et son mécanisme exact est inconnu. Le diagnostic et le traitement du SHC sont actuellement basés sur de petits rapports de cas. Les informations doivent continuer à être évaluées au fur et à mesure qu’elles sont disponibles afin d’assurer un traitement approprié.
1. Institut national sur l’abus des drogues (NIDA). Qu’est-ce que la marijuana ? www.drugabuse.gov/publications/research-reports/marijuana/what-marijuana. Consulté le 25 août 2016.
2. NIDA. Quelle est l’ampleur de la consommation de marijuana aux États-Unis ? www.drugabuse.gov/publications/research-reports/marijuana/what-scope-marijuana-use-in-united-states. Consulté le 25 août 2016.
3. Kim HS, Monte AA. La légalisation du cannabis au Colorado et son effet sur les soins d’urgence. Ann Emerg Med. 2016;68:71-75.
4. Cerdá M, Wall M, Keyes KM, et al. Lois sur la marijuana médicale dans 50 États : enquête sur la relation entre la légalisation de la marijuana médicale par les États et la consommation, l’abus et la dépendance à la marijuana. Drug Alcohol Depend. 2012;120:22-27.
5. CNN Money. Là où l’herbe est légale. http://money.cnn.com/interactive/news/economy/marijuana-legalization-map/index.html. Consulté le 25 août 2016.
6. Marijuana Policy Project. Législation de réforme de la politique de la marijuana en 2016. www.mpp.org/states/key-marijuana-policy-reform. Consulté le 13 novembre 2016.
7. NIDA. Comment la marijuana produit-elle ses effets ? www.drugabuse.gov/publications/research-reports/marijuana/how-does-marijuana-produce-its-effects. Consulté en août 2016.
8. Manzanares J, Julian MD, Carrascosa A. Rôle du système cannabinoïde dans le contrôle de la douleur et implications thérapeutiques pour la gestion des épisodes douloureux aigus et chroniques. Curr Neuropharmacol. 2006;4:239-257.
9. Galli JA, Sawaya RA, Friedenberg FK. Syndrome d’hyperémèse cannabinoïde. Curr Drug Abuse Rev. 2011;4:
241-249.
10. Allen JH, de Moore GM, Heddle R, Twartz JC. Hyperémèse cannabinoïde : hyperémèse cyclique en association avec l’abus chronique de cannabis. Gut. 2004;53:1566-1570.
11. Ruffle JK, Bajgoric S, Samra K, et al. Cannabinoid hyperemesis syndrome : an important differential diagnosis of persistent unexplained vomiting. Eur J Gastroenterol Hepatol. 2015;27:1403-1408.
12. Soriano-Co M, Batke M, Cappell MS. Le syndrome d’hyperémèse cannabique caractérisé par des nausées et des vomissements persistants, des douleurs abdominales et des bains compulsifs associés à la consommation chronique de marijuana : un rapport de huit cas aux États-Unis. Dig Dis Sci. 2010;55:3113-3119.
13. Ukaigwe A, Karmacharya P, Donato A. A gut gone to pot : a case of cannabinoid hyperemesis syndrome due to K2, a synthetic cannabinoid. Case Rep Emerg Med. 2014;2014:167098.
14. Hopkins CY, Gilchrist BL. Un cas de syndrome d’hyperémèse cannabinoïde causé par des cannabinoïdes synthétiques. J Emerg Med. 2013;45:544-546.
15. Simonetto DA, Oxentenko AS, Herman ML, Szostek JH. Hyperémèse cannabinoïde : une série de cas de 98 patients. Mayo Clin Proc. 2012;87:114-119.
16. Lu ML, Agito MD. Syndrome d’hyperémèse cannabinoïde : la marijuana est à la fois antiémétique et proémétique. Cleve Clin J Med. 2015;82:429-434.
17. Habboushe J, Sedor J. Insuffisance rénale aiguë par hyperémèse cannabinoïde : une séquelle fréquente du syndrome d’hyperémèse cannabinoïde. Am J Emerg Med. 2014;32:690.e1-e2.
18. Srihari P, Liu M, Punzell S, et al. Syndrome d’hyperémèse cannabinoïde associé à une douche compulsive et à une lésion rénale aiguë. Prim Care Companion CNS Disord. 2016;18(1).
19. Grégoire P, Tau M, Robertson D. Syndrome d’hyperémèse cannabinoïde et début d’un épisode maniaque. BMJ Case Rep. 2016;2016.
20. Bagdure S, Smalligan RD, Sharifi H, Khandheria B. Waning effect of compulsive bathing in cannabinoid hyperemesis. Am J Addict. 2012;21:184-185.
21. Witsil JC, Mycyk MB. L’halopéridol, un nouveau traitement pour le syndrome d’hyperémèse cannabinoïde. Am J Ther. 2014 Nov 12 .
22. Schulze DR, Carroll FI, McMahon LR. Interactions entre le transporteur de la dopamine et les ligands des récepteurs cannabinoïdes chez les singes rhésus. Psychopharmacologie (Berl). 2012;222:425-438.
23. Desai RI, Thakur GA, Vemuri VK, et al. Analyse de la tolérance et de la dépendance comportementale/physique pendant un traitement chronique aux agonistes CB1 : effets des agonistes, des antagonistes et des médicaments non cannabinoïdes CB1. J Pharmacol Exp Ther. 2013;344:319-328.
24. Hickey JL, Witsil JC, Mycyk MB. Halopéridol pour le traitement du syndrome d’hyperémèse cannabinoïde. Am J Emerg Med. 2013;31:1003.e5-e6.
25. Pélissier F, Claudet I, Gandia-Mailly P, et al. Syndrome d’hyperémèse cannabique aux urgences : quelle utilité pour une équipe spécialisée en addictologie ? Une étude pilote. J Emerg Med. 2016;51:544-551.