Formális töltések
A szerves molekulákhoz pozitív vagy negatív töltések is kapcsolódhatnak. A kémiai reakciók során gyakori, hogy a reaktáns, a köztes termékek és/vagy a termékek töltéssel rendelkeznek. A semleges és töltött kötésminták felismerése és megkülönböztetése hasznos lesz a reakciómechanizmusok elsajátításában. Nézzük meg a metanol, CH3OH Lewis-szerkezetét (a metanol az úgynevezett “faalkohol”, amelyet a gátlástalan szeszcsempészek néha árultak az 1920-as évek szesztilalmi időszakában, gyakran megvakultak azok, akik megitták). Maga a metanol semleges molekula, de elveszíthet egy protont, hogy molekuláris anionná (CH3O-) váljon, vagy nyerhet egy protont, hogy molekuláris kationná (CH3OH2+) váljon.

A molekuláris anion és a kation össztöltése -1, illetve +1 értékű. De ennél pontosabbak is lehetünk – minden molekuláris ionra azt is kijelenthetjük, hogy formális töltés kifejezetten az oxigénatomon található, nem pedig a szén- vagy bármelyik hidrogénatomon.
A molekula különböző atomjainak formális töltésének kiszámítása egyszerű folyamat – egyszerűen csak össze kell adni a valenciaelektronokat.
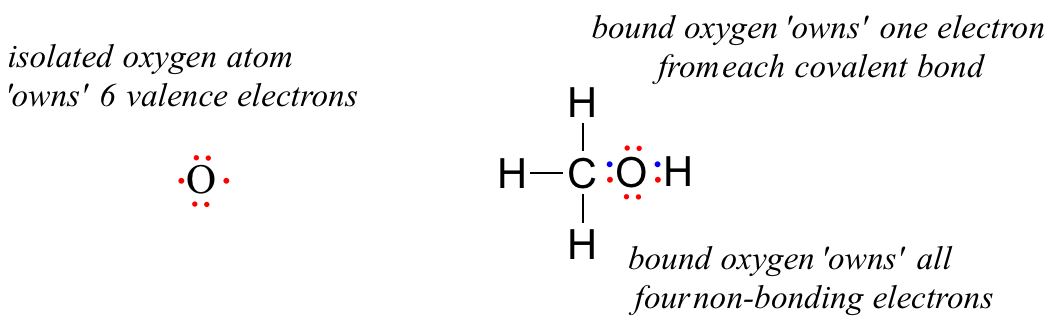
A nem kötött oxigénatomnak 6 valenciaelektronja van. Amikor azonban egy metanolmolekula részeként kötődik, az oxigénatomot 8 valenciaelektron veszi körül: 4 nem kötő elektron (két “magányos pár”) és 2 elektron a két kovalens kötésben (egy a szénhez, egy a hidrogénhez). A formális töltéskonvenció szerint azt mondjuk, hogy az oxigén mind a 4 nem kötődő elektront “birtokolja”. A két kovalens kötésből azonban csak egy-egy elektront “birtokol”, mivel a kovalens kötések az elektronok atomok közötti megosztásával járnak. Ezért a metanolban lévő oxigénatom 2 + 2 + (½ x 4) = 6 valenciaelektronnal rendelkezik.
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
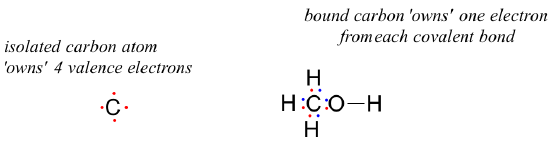
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
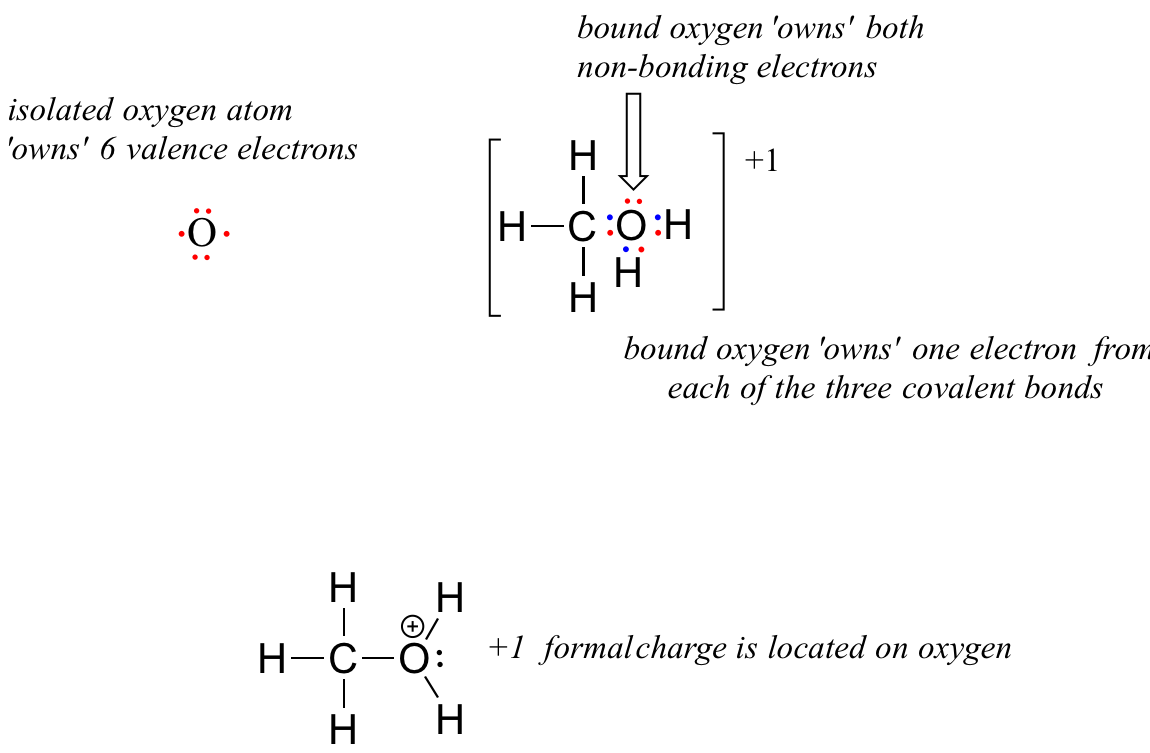
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
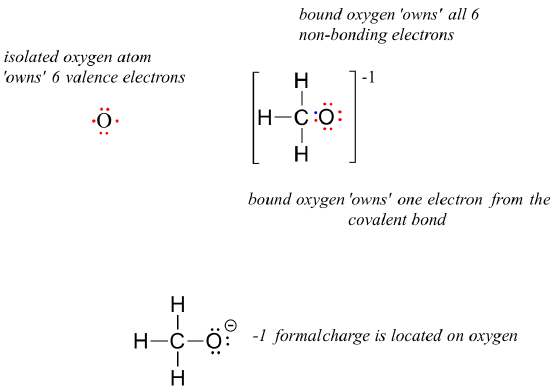
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
A szerves molekulák szerkezetének megrajzolásakor nagyon fontos, hogy az összes nem nulla formális töltést ábrázoljuk, tisztázva a töltések helyét. Egy olyan szerkezet, amelyből hiányoznak a nem nulla formális töltések, nem helyesen rajzolt, és valószínűleg a vizsgán is így fogják értékelni!
Az általános kémiában tanultakra visszagondolva most valószínűleg azt kérdezed: “Mi a helyzet a dipólusokkal?”. Az oxigénatom egy O-H kötésben nem “birtokol” többet az elektronsűrűségből, mint a hidrogén, mert nagyobb az elektronegativitása?” Ez teljesen igaz, és a későbbiekben át fogjuk tekinteni a kötési dipólusok fogalmát. A formális töltések kiszámítása szempontjából azonban a kötési dipólusok nem számítanak – mindig úgy tekintjük, hogy a kötésben lévő két elektron egyenlően oszlik meg, még akkor is, ha ez nem tükrözi pontosan a kémiai valóságot. A formális töltések csak formaságok, az elektronok könyvelésének módszere, amely a szerves vegyületek és ionok szerkezetének megrajzolására szolgáló Lewis rendszerhez kapcsolódik. Később látni fogjuk, hogyan segíthet a formális töltés fogalma a szerves molekulák reakcióinak szemléltetésében.
Végezetül, ne hagyjuk magunkat abba a hitbe ringatni, hogy csak azért, mert egy szerkezet nettó töltése nulla, nincsenek formális töltéssel rendelkező atomok: az egyik atomnak lehet pozitív, a másiknak negatív formális töltése, és a nettó töltés még mindig nulla. A zwitterionok, például az aminosavak, különböző atomokon pozitív és negatív formális töltésekkel is rendelkeznek:

Még ha a glicin nettó töltése nulla is, a pozitív és negatív formális töltések helyét mégis szükséges megmutatni.
GYakorlat 1.4
Töltsd ki az alábbi szerkezetekben a hiányzó magányos elektronpárokat és formális töltéseket. Tegyük fel, hogy minden atomnak teljes valenciahéjjal rendelkeznek az elektronok. A nettó töltések a zárójelen kívül vannak feltüntetve.
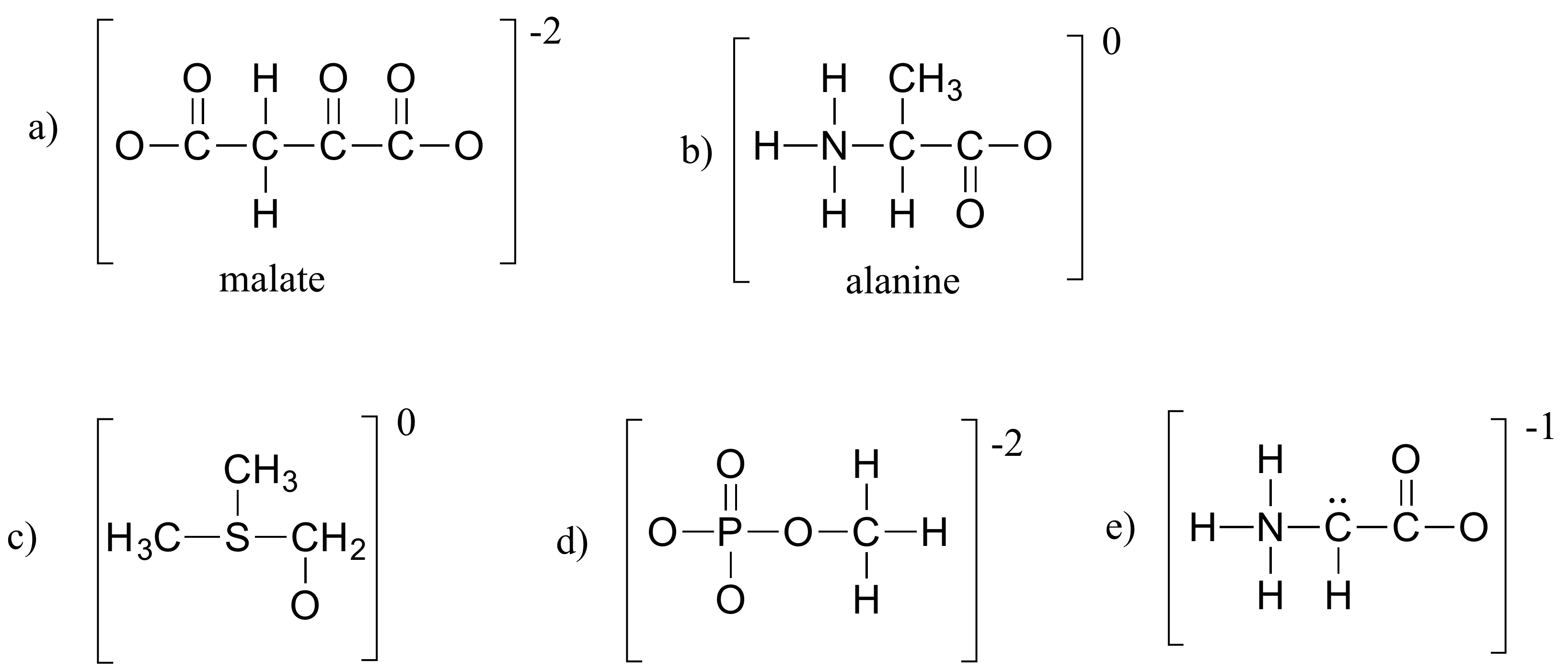
A feladatok megoldása