Elektronegativitás és a kötés polaritása
Noha a kovalens kötést elektronmegosztásként definiáltuk, a kovalens kötésben az elektronok nem mindig egyenlően oszlanak meg a két kapcsolt atom között. Hacsak a kötés nem ugyanannak az elemnek két atomját köti össze, mint a H2 esetében, mindig lesz olyan atom, amely erősebben vonzza az elektronokat a kötésben, mint a másik atom, mint a \(\PageIndex{1}\) ábrán látható HCl esetében. Az olyan kovalens kötést, amelyben az elektronok egyenlően oszlanak meg (\(\(\PageIndex{1a}\) ábra), nem poláris kovalens kötésnek nevezzük. Az olyan kovalens kötést, amelyben az elektronok egyenlőtlenül oszlanak meg, mint a \(\PageIndex{1b}\) ábrán, poláros kovalens kötésnek nevezzük.

A poláros kötésben az elektronsűrűség eloszlása egyenlőtlen. Az elektronokat jobban vonzó atom körül nagyobb, mint a másik körül. Például a hidrogén-klorid molekula H-Cl kötésében az elektronok több időt töltenek a klóratom közelében, mint a hidrogénatom közelében. Figyeljük meg, hogy a \(\PageIndex{1b}\) ábrán a Cl körüli árnyékolt terület sokkal nagyobb, mint a H körül.
Az elektronsűrűség e kiegyensúlyozatlansága a kötés egyik oldalán (Cl) részben negatív (δ-), a másik oldalán (H) részben pozitív (δ+) töltést eredményez. Ez látható a \(\PageIndex{2a}\) ábrán. A poláris kovalens kötésben a töltések szétválása elektromos dipólust (két pólust) eredményez, amelyet a \(\PageIndex{2b}\) ábrán a nyíl ábrázol. A nyíl iránya a δ- vég felé mutat, míg a nyíl + farka a kötés δ+ végét jelzi.
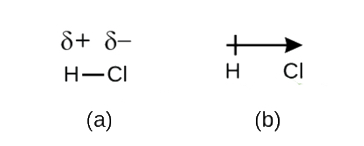
Ábra \(\PageIndex{2}\): (a) A kötési elektronpár egyenlőtlen megosztása a H és a Cl között a H atomon részben pozitív, a Cl-en pedig részben negatív töltést eredményez. A δ+ és δ- jelek a H-Cl kötés polaritását jelzik. (b) A dipólust egy nyíl ábrázolja, a farkán kereszttel. A kereszt a δ+ vége közelében van, a nyílhegy pedig egybeesik a δ-ével.
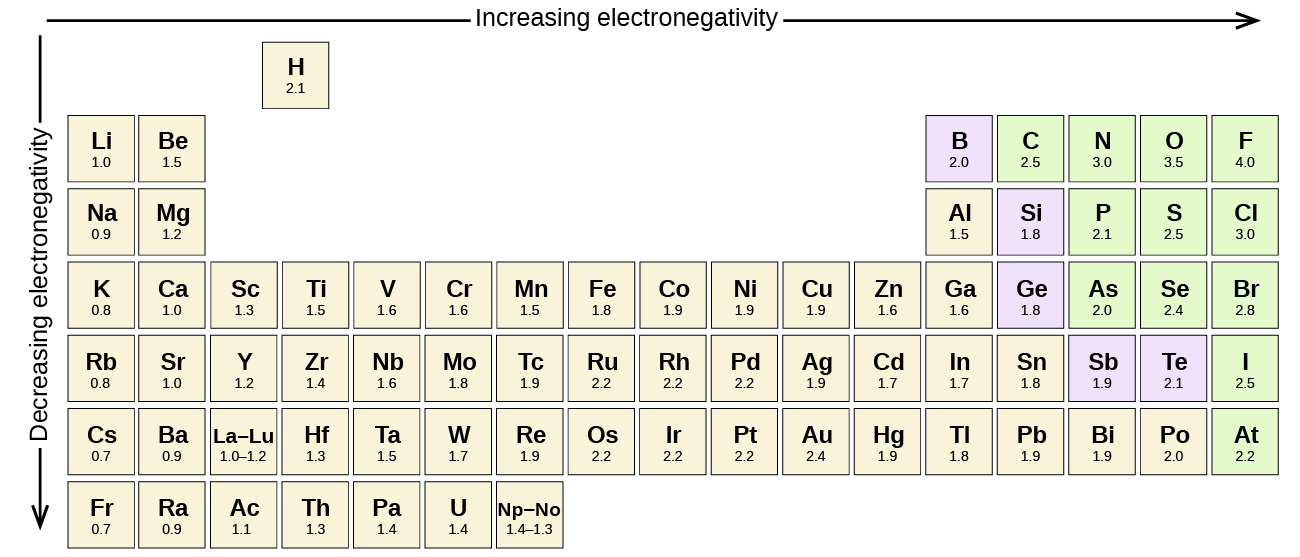
A különböző elemek atomjai közötti minden kovalens kötés poláris kötés, de a polaritás mértéke széles skálán mozog. Egyes kötések különböző elemek között csak minimálisan polárisak, míg mások erősen polárisak. Az ionos kötések tekinthetők a polaritás csúcsának, ahol az elektronokat inkább átadják, mint megosztják. A kovalens kötések relatív polaritásának megítéléséhez a kémikusok az elektronegativitást használják, amely annak relatív mérőszáma, hogy egy atom milyen erősen vonzza az elektronokat, amikor kovalens kötést képez. Az elektronegativitás értékelésére különböző numerikus skálák léteznek. A \(\PageIndex{3}\) ábra az egyik legnépszerűbbet, a Pauling-skálát mutatja.
Közelebbről nézve: Linus Pauling (1901-94) vitathatatlanul a 20. század legnagyobb hatású kémikusa, Linus Pauling (1901-94) az egyetlen ember, aki két egyéni (azaz nem megosztott) Nobel-díjat kapott. Az 1930-as években Pauling új matematikai elméletek segítségével megfogalmazta a kémiai kötés néhány alapelvét. Az 1939-ben megjelent The Nature of the Chemical Bond (A kémiai kötés természete) című könyve a kémia egyik legjelentősebb könyve.
1935-ben Pauling érdeklődése a biológiai molekulák felé fordult, és a fehérjék szerkezetével kapcsolatos munkájáért 1954-ben kémiai Nobel-díjat kapott. (Nagyon közel járt a DNS kettős spirál szerkezetének felfedezéséhez, amikor James Watson és James Crick 1953-ban bejelentette saját felfedezését a DNS szerkezetéről.) Később 1962-ben Nobel-békedíjat kapott a nukleáris fegyverek tesztelésének betiltásáért tett erőfeszítéseiért.

Linus Pauling a 20. század egyik legnagyobb hatású kémikusa volt.
Késői éveiben Pauling meggyőződése lett, hogy a nagy dózisú C-vitamin megelőzi a betegségeket, köztük a náthát. A legtöbb klinikai kutatás nem mutatott ki összefüggést, de Pauling továbbra is nagy adagokat szedett naponta. 1994-ben halt meg, miután egy életen át olyan tudományos örökséget hagyott hátra, amellyel kevesen fognak felérni.
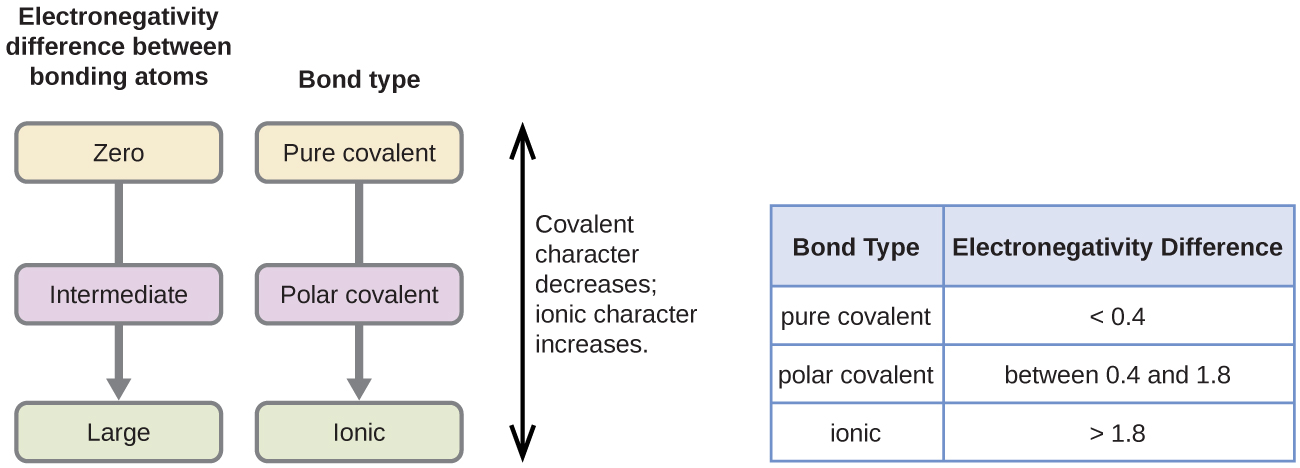
A kovalens kötés polaritását a kötést létrehozó két atom elektronegativitása közötti különbség meghatározásával lehet megítélni. Minél nagyobb az elektronegativitások különbsége, annál nagyobb az elektronmegosztás egyensúlytalansága a kötésben. Bár nincsenek szigorú szabályok, az általános szabály az, hogy ha az elektronegativitások különbsége kisebb, mint 0,4, akkor a kötés nem polárisnak tekinthető; ha a különbség nagyobb, mint 0,4, akkor a kötés polárisnak tekinthető. Ha az elektronegativitások közötti különbség elég nagy (általában 1,8-nál nagyobb), akkor a keletkező vegyületet inkább ionosnak, mint kovalensnek tekintjük. A nulla elektronegativitáskülönbség természetesen nem poláros kovalens kötést jelez.
Példa \(\PageIndex{1}\)
Írd le az egyes atompárok közötti elektronegativitáskülönbséget és az ebből eredő polaritást (vagy kötéstípust).
- C és H
- H és H
- Na és Cl
- O és H
Megoldás
- A szén elektronegativitása 2,5, míg a hidrogéné 2,1. A különbség 0,4, ami meglehetősen kicsi. A C-H kötés ezért nem polárisnak tekinthető.
- Mindkét hidrogénatom elektronegativitási értéke azonos-2,1. A különbség nulla, tehát a kötés nem poláros.
- A nátrium elektronegativitása 0,9, míg a klóré 3,0. A különbség 2,1, ami meglehetősen nagy, így a nátrium és a klór ionos vegyületet alkot.
- A hidrogén esetében 2,1, az oxigén esetében 3,5, az elektronegativitáskülönbség 1,4. Nagyon poláris kötést várnánk. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.