A telítetlenségi fok számítása (DoU)
A telítetlenségi fokot (DoU) kettőskötés-egyenértéknek is nevezik. Ha a molekuláris képlet meg van adva, dugja be a számokat ebbe a képletbe:
\
- \(C\) a szénatomok száma
- \(N\) a nitrogének száma
- \(X\) a halogének száma (F, Cl, Br, I)
- \(H\) a hidrogének száma
Amint korábban említettük, a telített molekula csak egyszerű kötéseket tartalmaz, gyűrűket nem. Ezt másképpen úgy is értelmezhetjük, hogy egy telített molekula a lehető legtöbb hidrogénatomot tartalmazza, hogy aciklikus alkán legyen. Így a hidrogénatomok száma 2C+2-vel ábrázolható, ami az alkán általános molekuláris ábrázolása. Például a C3H4 molekulaformula esetében a tényleges hidrogénatomok száma, amely ahhoz szükséges, hogy a vegyület telített legyen, 8 . A vegyületnek további 4 hidrogénre van szüksége ahhoz, hogy teljesen telített legyen (várt hidrogénszám – megfigyelt hidrogénszám=8-4=4). A telítetlenségi fok 2, azaz a molekulának a telítettnek minősítéshez szükséges hidrogénszám fele. Ezért a DoB képlet osztja 2-vel. A képlet kivonja az X-ek számát, mert egy halogén (X) helyettesíti a hidrogént a vegyületben. Például a klóretánban, C2H5Cl, eggyel kevesebb hidrogén van, mint az etánban, C2H6.
Ahhoz, hogy egy vegyület telített legyen, a nitrogén jelenlétében eggyel több hidrogén van a molekulában. Ezért hozzáadjuk a nitrogének számát (N). Ezt láthatjuk a C3H9N esetében a C3H8-hoz képest. Az oxigén és a kén nem szerepel a képletben, mert a telítettséget ezek az elemek nem befolyásolják. As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, a telítetlenségi fokok csak a kettős kötések, hármas kötések és/vagy gyűrűk összegét adják meg. Például egy 3 telítetlenségi fok tartalmazhat 3 gyűrűt, 2 gyűrűt+1 kettős kötést, 1 gyűrű+2 kettős kötést, 1 gyűrű+1 hármas kötést, 1 kettős kötés+1 hármas kötést vagy 3 kettős kötést.
Példa:
Melyik a benzol telítetlenségi foka?
Megoldás
A benzol molekulaformulája C6H6. Így,
DoU= 4, ahol C=6, N=0,X=0 és H=6. 1 DoB 1 gyűrűnek vagy 1 kettős kötésnek felelhet meg. Ez megfelel annak, hogy a benzol 1 gyűrűt és 3 kettős kötést tartalmaz.
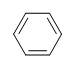
Ha azonban a C6H6 molekuláris képletet kapjuk, a benzol csak egy a sok lehetséges szerkezet (izomer) közül. A következő szerkezetek DoB értéke mind 4, és molekuláris képletük megegyezik a benzoléval.