1. Az Erk jelátvitel áttekintése
Az extracelluláris jel-szabályozott kináz (ERK) útvonal a mitogén aktivált protein kináz (MAPK) jelátviteli útvonal egyik fő jelátviteli kazettája. Az ERK kaszkádot számos extracelluláris ágens aktiválja, beleértve a növekedési faktorokat, hormonokat és a sejtszintű stresszt is, hogy olyan sejtfolyamatokat indukáljon, amelyek közé elsősorban a proliferáció és a differenciálódás tartozik, de bizonyos körülmények között stresszválasz és mások is. A MAPK/ERK-kináz (MEKK) fő komponensei a Raf család Raf-1, A-Raf és B-Raf tagjai, amelyek a MAPK/ERK-kináz (MEK) MEK1/2 komponenseinek két szerin-maradványát foszforilálják. Az ERK1/2 felelős a downstream effektorok stimulálásáért, amelyek közül sok transzkripciós faktor. Az egyik legfontosabb transzkripciós faktor a ciklikus AMP válaszelem-kötő fehérje (CREB).
Ez az ERK-útvonal számos sejtfolyamat szabályozásához járul hozzá:
– A sejtproliferáció szabályozása, mint például a T-sejtek aktiválása
– A szinaptikus plaszticitás, mint például a hosszú…(LTP) a hippokampusz neuronjaiban
– Az endotélsejtek proliferációja az angiogenezis során
– A p53 transzkripciós faktor foszforilációja
– Az ERK jelátviteli útvonal átalakulása hozzájárulhat a policisztás vesebetegség kialakulásához
– A foszfolipáz A2 (PLA2) aktiválása hízósejtekben.
2. Erk jelátviteli kaszkád
Az ERK1/2 kaszkád aktiválódása többnyire membránreceptorokon, például receptor-Tyr-kinázokon (RTK-k), G-proteinhez kapcsolt receptorokon (GPCR-k), ioncsatornákon és másokon indul be. Ezek a receptorok a jelet adaptorfehérjék (pl. Grb2) és cserefaktorok (pl. SOS) toborzásával továbbítják, amelyek viszont a Ras aktiválódását indukálják a plazmamembránokon vagy más organellumok membránjain. Az aktivált, GTP-hez kötött Ras ezután e kaszkád MAP3K szintjén belül a Raf-1, B-Raf és A-Raf (Rafs) fehérjekinázok aktiválásával továbbítja a jelet. Ez az aktiválás úgy történik, hogy a Raf-ok a membránokhoz rekrutálódnak, ahol aztán foszforilálódnak és aktiválódnak. A MOS az ERK kaszkád másik MAP3K-ja, de elsősorban a reproduktív rendszerben működik, egy eltérő szabályozási móddal. A MAP3K szintről a jel ezután a MAPKK komponenseken keresztül továbbítja a kaszkádot lefelé: MEK1/2. Ezek aktiválódnak az aktivációs hurokban lévő, MAPKK-ra jellemző Ser-Xaa-Ala-Xaa-Ser/Thr motívum szerin-foszforilációján keresztül. A MEK1/2 viszont aktiválja egyetlen ismert szubsztrátjukat, a natív ERK1/2-t, amelyek egyedüli downstream célpontjaiként működnek, ami arra utal, hogy a MEK1/2 az ERK1/2 kaszkád specifitást meghatározó komponensei. A MEK1/2 az egyetlen kettős specifitású fehérje kináz, amely képes foszforilálni az ERK1/2 szabályozó Thr és Tyr maradékát is. Az ERK1/2 mintegy 200 különböző szubsztrátját azonosították eddig. Ezek vagy a citoszolban (pl. PLA2 RSK), vagy transzlokáció után a sejtmagban lévő szubsztrátumok, köztük olyan transzkripciós faktorok, mint az Elk1, a c-Fos és a c-Jun.
– MAP3K-Raf 1
A MAP3K kaszkád szintjén a növekedési faktorok jelátviteli molekulái közül a Raf-1 a legjobban tanulmányozott. Ez egy 70-75 kDa fehérje szerin/treonin kináz, amely a molekula COOH-terminális felében egy kinázdomént, a maradék részében pedig egy szabályozó domént foglal magában. Különböző mitogénekkel történő stimuláció hatására a Raf-1 2-3 mm-en belül átmeneti aktiváción megy keresztül. A Raf-1 aktiválódásának mechanizmusát az elmúlt években alaposan tanulmányozták. Ma már egyértelmű, hogy a Raf-1 a HAS-tól lefelé helyezkedik el, amely úgy tűnik, hogy stimulációkor közvetlenül kölcsönhatásba lép a Raf-1 NH2-terminális részével.
– MAPKK-MEK1/2
A MEK-ek a fehérje szerin/treonin kinázok evolúciósan konzervált családját alkotják, amely a mai napig három, nagymértékben homológ (85%) emlős izoformát tartalmaz. A MEK-1 aktiválódásának mechanizmusa kizárólag szerin-maradékokon történő fehérje-foszforilációt foglal magában, és úgy tűnik, hogy hasonló, akár a MEKK, akár a Raf-1, akár az autofoszforiláció foszforilálja, amint azt a foszfopeptid-térképek meghatározzák. A MAPKK-k (MEK-ek) rendkívül specifikusak az ERK-1 és ERK-2 downstream komponenseire. Ezenkívül a MAPKK nem ismerte fel sem a szubsztrátjának denaturált formáját, sem az ERK foszforilációs helyeit tartalmazó peptideket, ami arra utal, hogy az enzimnek a MAPK natív formájára van szüksége.
– MAPK-ERK-1/2
Az ERK-1 és az ERK-2 nagyfokú hasonlóságuk miatt általában funkcionálisan redundánsnak tekintik őket. A fő upstream mechanizmus, amely az ERK-1 és -2 foszforilációjához vezet mindkét szabályozó maradékon, a MEK általi foszforilációjuk. A szubsztrátfelismerés meglehetősen széleskörű jellege miatt az ERK-k aktiválásuk után számos fehérjét képesek foszforilálni. Ezek a fehérjék gyakran szabályozó jellegűek, és mind a citoplazmában, mind a sejtmagban találhatók.
3. Az Erk útvonal downstream jelátvitele
– Sejtproliferáció
Az aktivált ERK1/2 foszforilálja az RSK-t, és mind az RSK, mind az ERK transzlokálódik a sejtmagba, ahol számos transzkripciós faktort, például a CREB-t, a Fos-t és az Elk-1-et aktiválja, ami végül effektorfehérje-szintézist eredményez és változásokat okoz a sejtproliferációban és túlélésben. A CREB (cAMP válaszelem-kötő fehérje) egy olyan sejtes transzkripciós faktor, amely képes a génátírást több mint 10-szeresére fokozni. A c-fos egy 380 aminosavból álló fehérje, amely a dimerizáció és a DNS-kötés érdekében egy bázikus leucin cipzáras régióval és a C-terminuson egy transzaktivációs doménnel rendelkezik. Fontos sejtes eseményekben vesz részt, beleértve a sejtproliferációt, differenciálódást és túlélést; az ETS domént tartalmazó fehérje (Elk-1) egy olyan fehérje, amelyet emberben az ELK1 gén kódol. Az Elk-1 funkciója transzkripciós aktivátorként is működik.
– Onkogenezis
– AzERK1/2 aktivációja elősegíti a metapláziát és a tumor kialakulását azáltal, hogy foszforilálja a Bim-et és a Bid-et, és a Bim proteaszómás degradációját, valamint a Bad foszforszerin-kötő fehérjékhez való szekvenálását és ezáltal az apoptózis gátlását okozza. Egy külön útvonalon az ERK1/2 aktivációja foszforilálja a FOXO3a-t a Ser 294, Ser 344 és Ser 425-nél, és elősegíti a FOXO3a-MDM2 kölcsönhatást. Ez a kölcsönhatás fokozza a FOXO3a degradációját egy MDM2-függő ubikvitin- proteaszóma útvonalon keresztül, ami tumor kialakulásához vezet.
– Fejlődés és differenciálódás
A Ras/Raf/MAP-kináz útvonalat aktiváló receptor- tirozinkinázok általi jelátvitel számos sejttípus fejlődését és differenciálódását szabályozza. Elsősorban a transzkripciós jelátvivő és aktiváló fehérjék (STAT) aktiválásán keresztül.
– Sejtciklus
A Cdc25 aktiválja a ciklinfüggő kinázokat azáltal, hogy foszfátot távolít el a Cdk aktív helyén lévő maradékokból. Ismert, hogy szabályozza a G1 fázisból az S fázisba és a G2 fázisból az M fázisba való átmenetet. Az Erk1/2 aktiválhatja a Cdc25 fehérjét, és ezzel elősegítheti a sejtciklus progresszióját.
4. Az Erk jelátvitel szabályozása
Az Erk jelátvitel szabályozása nagyon fontos számunkra a sejtek normális működésének fenntartásához. Az Erk jelátviteli útvonal szabályozására többféle szabályozási stratégia létezik a sejt számára, ezek közé tartozik elsősorban a visszacsatolási hurkok általi szabályozás, a felfelé és lefelé áramló állványok, a foszfatáz és az Erk jelátviteli útvonal gátlói.
– Visszacsatolási hurkok szabályozása
Az ERK útvonalban több ponton is van negatív visszacsatolás (1. ábra). A MEK az egyik célpont, és az ERK gátolhatja a MEK1/2 foszforilációját a Thr292 és Thr212 ponton. A foszforiláció megakadályozza a MEK aktivitásának további fokozását a PAK1 által, és ezáltal csökkenti az ERK aktiválódását. A Raf több helyen történő foszforilációja az ERK által egy második lehetséges visszacsatolási hurokmechanizmust biztosít. E helyek túlfoszforilációja megakadályozza a Raf kölcsönhatását a Ras GTPázzal, és elősegíti a foszforilációját a PP2A foszfatáz által. A foszfatázok ERK általi aktiválása vagy transzkripciós felszabályozása egy alternatív negatív visszacsatolási mechanizmus. Ezek a különböző ERK-aktivált negatív visszacsatolási hurkok jelentik az egyik eszközt a jelátvitel időtartamának korlátozására és az útvonal alapállapotba való visszatérésére.
– Felfelé és lefelé áramló vázak szabályozása
A vázfehérjék egy jelátviteli útvonal két vagy több komponensét kötik meg, hogy közeli közelségbe hozzák őket, és ezáltal elősegítsék funkcionális kölcsönhatásukat. Ezenkívül a scaffoldok ezeket a több enzimből álló jelátviteli modulokat különböző sejtszintű helyekre irányíthatják, és ezáltal fokozhatják a down-stream szubsztrátok egy meghatározott alcsoportjának foszforilációját. Az állványok befolyásolják a jel időtartamát is, megakadályozzák a hasonló útvonalak közötti keresztbeszélgetést, és a jelátviteli modul aktiválását egy adott upstream aktiváló jelhez köthetik.
– Foszfatáz és inhibitorok
A MAPK-útvonalak aktivitását a upstream kinázok és a gátló foszfatázok versengő hatása határozza meg. A MAPK-útvonalakat komponenseiknek több foszfatáz által végzett defoszforilációja zárja le. Számos szerin/treonin foszfatáz, például a PP2A és a PP2Ca, valamint tirozin foszfatáz, például a PTP-SL és a HePTP inaktiválja a MAPK-kat.
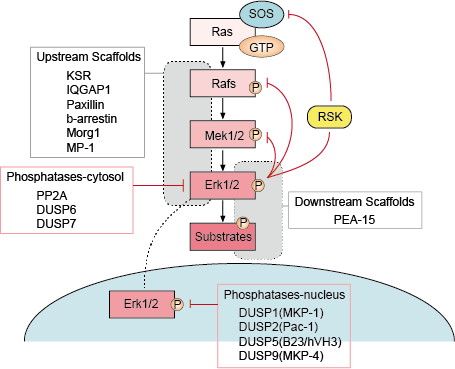
1. ábra. Az Erk jelátviteli útvonal szabályozása
5. Kapcsolat a betegségekkel
A MAPK jelátviteli útvonalakat a kulcsfontosságú sejtaktivitásokban, többek között a sejtproliferációban, differenciálódásban, túlélésben vagy halálban betöltött kritikus szerepükkel összhangban számos emberi betegség patogenezisében is szerepet játszanak.
– Alzheimer-kór
Az Alzheimer-kór (AD) egy neurodegeneratív betegség, amelyet kognitív és memóriazavar jellemez, és amelyről úgy gondolják, hogy az agyban mind az amiloid-β-t (Aβ) tartalmazó szenilis plakkok, mind a mikrotubulus-asszociált tau fehérjét tartalmazó neurofibrilláris csomók kialakulásának eredménye. A bizonyítékok tehát arra utalnak, hogy a MAPK jelátviteli útvonalak hozzájárulhatnak az Alzheimer-kór patogeneziséhez a neuronális apoptózis, a β- és γ-szekretáz aktivitás, valamint az APP és a tau foszforilációjának szabályozásán keresztül.
– Parkinson-kór
A Parkinson-kór (PD) a második leggyakoribb neurodegeneratív betegség. Különböző megfigyelések arra utalnak, hogy a MAPK jelátviteli útvonalak hozzájárulnak az α-szinuklein aggregátumok vagy a parkin vagy a DJ-1 funkcionális hiányosságai által kiváltott neuroinflammatorikus válaszokhoz és neuronális halálhoz a Parkinson-kór patogenezisében.
– MAPK jelátvitel a rákban
A MAPK jelátviteli útvonalak összetevőinek számos rák-asszociált mutációját találták a Ras és B-Raf jelátviteli útvonalakban, amelyek mindketten részt vesznek az ERK jelátviteli útvonalban. Az ERK jelátviteli útvonal a daganatok kialakulásának számos lépésében szerepet játszik. Az ERK által foszforilált fehérjék, például a miozin könnyűlánc-kináz, a kalpain, a fókuszos adhéziós kináz és a paxillin elősegíti a rákos sejtek migrációját. Továbbá az ERK1/2 jelátvitel szabályozza a Bcl-2 családba tartozó fehérjék, például a pro-apoptotikus BIM fehérje és az anti-apoptotikus MCL-1 fehérje aktivitását és szintjét, ezáltal elősegítve a rákos sejtek túlélését.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |