Bevezetés
Az ionos kötés a valenciaelektron(ok) teljes átadása az atomok között. Ez egy olyan típusú kémiai kötés, amely két ellentétesen töltött iont hoz létre. Az ionos kötésekben a fém elektronokat veszít, és pozitív töltésű kationná válik, míg a nemfém felveszi ezeket az elektronokat, és negatív töltésű anionná válik. Az ionos kötésekhez egy elektrondonor, gyakran egy fém, és egy elektronakceptor, egy nemfém szükséges.
Az ionos kötés azért figyelhető meg, mert a fémek legkülső pályáin kevés elektron található. Ezen elektronok elvesztésével ezek a fémek nemesgáz-konfigurációt érhetnek el, és megfelelnek a nyolcas szabálynak. Hasonlóképpen, a nemfémek, amelyeknek közel 8 elektron van a valenciahéjukban, hajlamosak arra, hogy könnyen fogadjanak el elektronokat a nemesgáz-konfiguráció elérése érdekében. Az ionos kötésekben 1-nél több elektron adható vagy vehető fel, hogy teljesüljön a nyolcadszabály. Az anion és a kation töltése megfelel a leadott vagy kapott elektronok számának. Ionkötésekben a vegyület nettó töltésének nullának kell lennie.
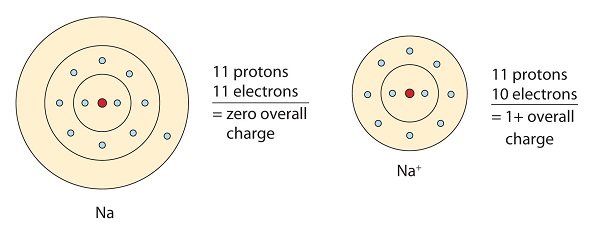
Ez a nátrium molekula a magányos elektront adja le a valencia-orbitálján, hogy elérje az oktett konfigurációt. Így egy pozitív töltésű kation jön létre az elektronvesztés miatt.
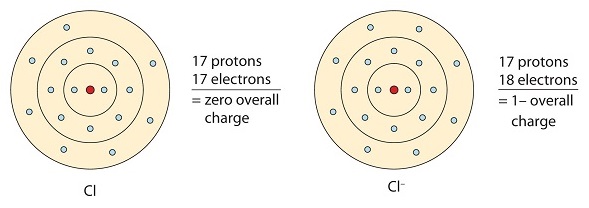
Ez a klóratom egy elektront kap az oktett konfiguráció elérése érdekében, így egy negatív töltésű anion jön létre.
Az ionos kötési folyamat előre jelzett teljes energiája, amely magában foglalja a fém ionizációs energiáját és a nemfém elektronaffinitását, általában pozitív, ami azt jelzi, hogy a reakció endoterm és kedvezőtlen. Ez a reakció azonban rendkívül kedvező a részecskék közötti elektrosztatikus vonzás miatt. Az ideális atomok közötti távolság mellett e részecskék közötti vonzás elegendő energiát szabadít fel a reakció elősegítéséhez. A legtöbb ionos vegyület hajlamos disszociálni poláris oldószerekben, mivel gyakran polárisak. Ez a jelenség az egyes ionok ellentétes töltéseinek köszönhető.
Példa \(\PageIndex{1}\):
.jpg?revision=2)
Ebben a példában a nátriumatom 1 valenciaelektronját adja a klóratomnak. Így egy nátrium-kation és egy klór-anion jön létre. Vegyük észre, hogy a keletkező vegyület nettó töltése 0.
.jpg?revision=2)
Ebben a példában a magnéziumatom mindkét valenciaelektronját a klóratomnak adja. Minden klóratom csak 1 elektront tud felvenni ahhoz, hogy elérje nemesgáz-konfigurációját; ezért 2 klóratomra van szükség a magnézium által leadott 2 elektron felvételéhez. Notice that the net charge of the compound is 0.