Cariche formali
Le molecole organiche possono anche avere cariche positive o negative ad esse associate. Durante le reazioni chimiche, è comune avere reattivi, intermedi e/o prodotti carichi. Riconoscere e distinguere tra schemi di legame neutri e carichi sarà utile per imparare i meccanismi di reazione. Consideriamo la struttura di Lewis del metanolo, CH3OH (il metanolo è il cosiddetto “alcol di legno” che contrabbandieri senza scrupoli vendevano a volte durante il proibizionismo negli anni ’20, spesso causando la cecità delle persone che lo bevevano). Il metanolo stesso è una molecola neutra, ma può perdere un protone per diventare un anione molecolare (CH3O-), o guadagnare un protone per diventare un catione molecolare (CH3OH2+).

L’anione molecolare e il catione hanno cariche complessive di -1 e +1, rispettivamente. Ma possiamo essere più specifici di così – possiamo anche affermare per ogni ione molecolare che una carica formale si trova specificamente sull’atomo di ossigeno, piuttosto che sul carbonio o su uno qualsiasi degli atomi di idrogeno.
Capire la carica formale sui diversi atomi di una molecola è un processo semplice – si tratta semplicemente di sommare gli elettroni di valenza.
Un atomo di ossigeno non legato ha 6 elettroni di valenza. Quando è legato come parte di una molecola di metanolo, tuttavia, un atomo di ossigeno è circondato da 8 elettroni di valenza: 4 elettroni non legati (due ‘coppie solitarie’) e 2 elettroni in ciascuno dei suoi due legami covalenti (uno al carbonio, uno all’idrogeno). Nella convenzione di carica formale, diciamo che l’ossigeno “possiede” tutti e 4 gli elettroni non legati. Tuttavia, “possiede” solo un elettrone da ciascuno dei due legami covalenti, perché i legami covalenti implicano la condivisione di elettroni tra gli atomi. Pertanto, l’atomo di ossigeno nel metanolo possiede 2 + 2 + (½ x 4) = 6 elettroni di valenza.
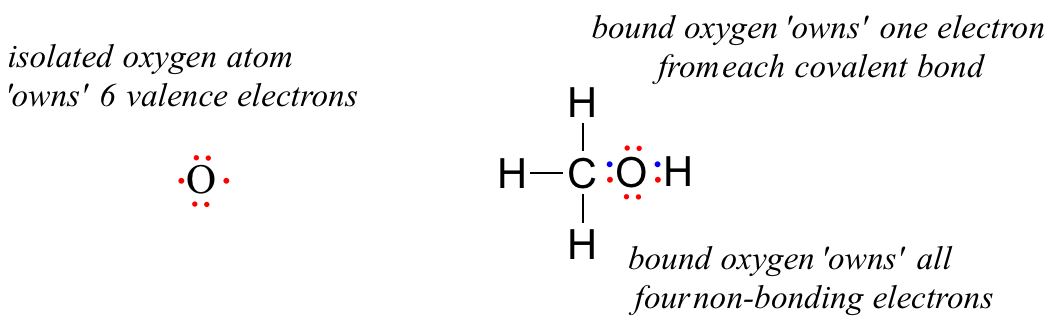
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
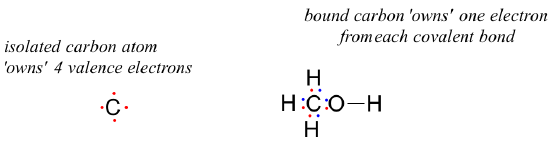
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
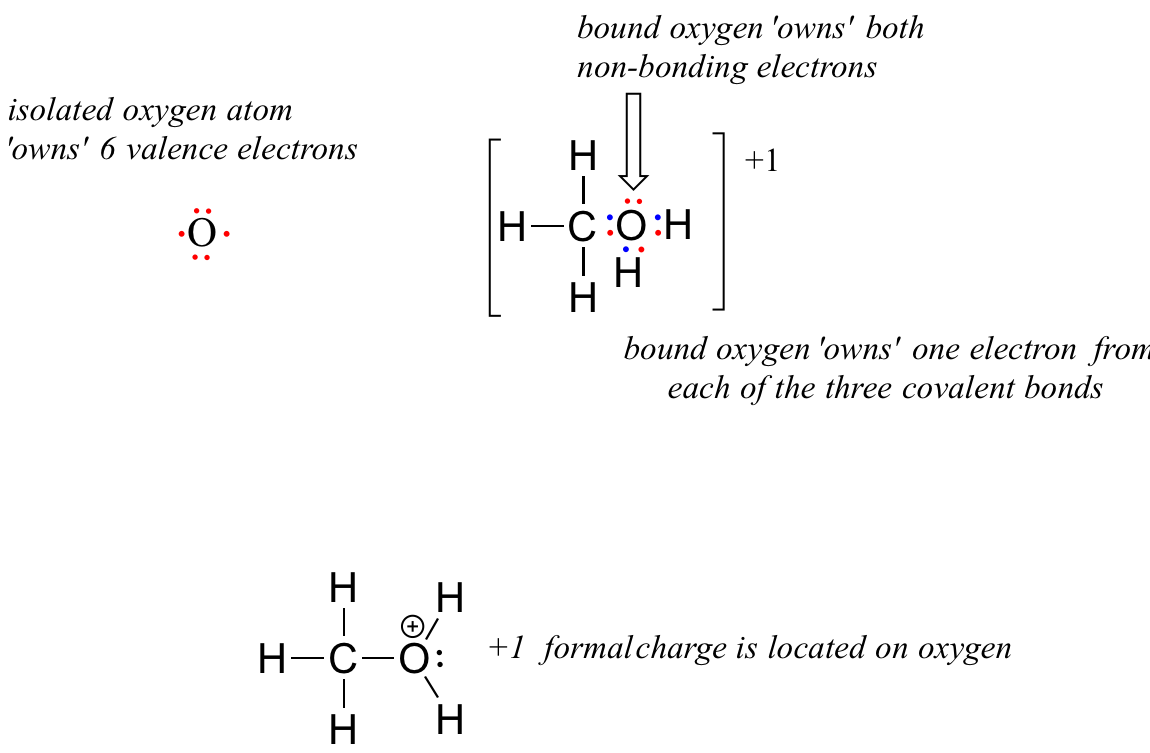
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
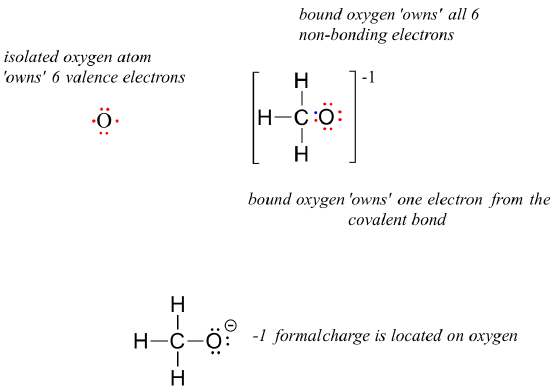
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Quando si disegnano le strutture delle molecole organiche, è molto importante mostrare tutte le cariche formali non nulle, essendo chiaro dove si trovano le cariche. Una struttura che manca di cariche formali non-zero non è disegnata correttamente, e probabilmente sarà segnata come tale in un esame!
A questo punto, ripensando a ciò che hai imparato in chimica generale, ti starai chiedendo “E i dipoli? Un atomo di ossigeno in un legame O-H non “possiede” più densità di elettroni dell’idrogeno, a causa della sua maggiore elettronegatività? Questo è assolutamente corretto, e rivedremo il concetto di dipoli di legame più avanti. Ai fini del calcolo delle cariche formali, tuttavia, i dipoli di legame non hanno importanza – consideriamo sempre che i due elettroni in un legame siano condivisi equamente, anche se questo non è un riflesso accurato della realtà chimica. Le cariche formali sono solo questo – una formalità, un metodo di contabilizzazione degli elettroni che è legato al sistema Lewis per disegnare le strutture dei composti organici e degli ioni. Più avanti, vedremo come il concetto di carica formale può aiutarci a visualizzare come reagiscono le molecole organiche.
Infine, non bisogna pensare che solo perché la carica netta su una struttura è zero non ci siano atomi con cariche formali: un atomo potrebbe avere una carica formale positiva e un altro una carica formale negativa, e la carica netta sarebbe ancora zero. Gli zwitterioni, come gli aminoacidi, hanno cariche formali sia positive che negative su atomi diversi:

Anche se la carica netta sulla glicina è zero, è comunque necessario mostrare la posizione delle cariche formali positive e negative.
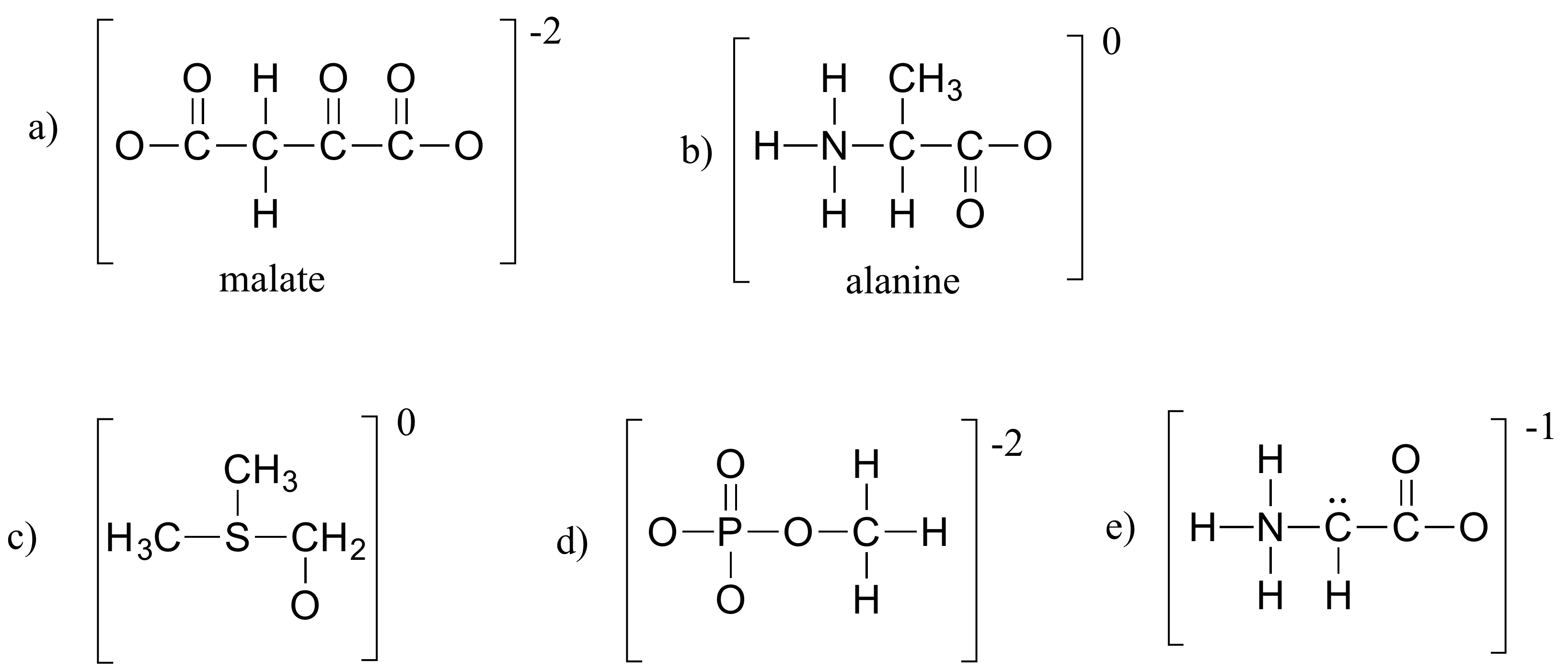
Esercizio 1.4
Riempi tutti gli elettroni di coppia solitaria e le cariche formali mancanti nelle strutture seguenti. Assumi che tutti gli atomi abbiano un guscio di valenza completo di elettroni. Le cariche nette sono mostrate fuori dalle parentesi.
Soluzioni agli esercizi