Teoria MO e legami pi coniugati
Il vantaggio di usare la teoria MO per capire il legame nelle molecole organiche diventa più evidente quando pensiamo ai legami pi. Consideriamo prima il legame pi greco nell’etene dal punto di vista della teoria MO (in questo esempio trascureremo i legami s nella molecola e penseremo solo al legame π). Iniziamo con due orbitali atomici: un orbitale 2p non ibridizzato per ogni carbonio. Ognuno contiene un singolo elettrone. Nella teoria MO, i due atomici si combinano matematicamente per formare due orbitali pi molecolari, uno a bassa energia pi di legame e uno ad alta energia pi* anti legame.
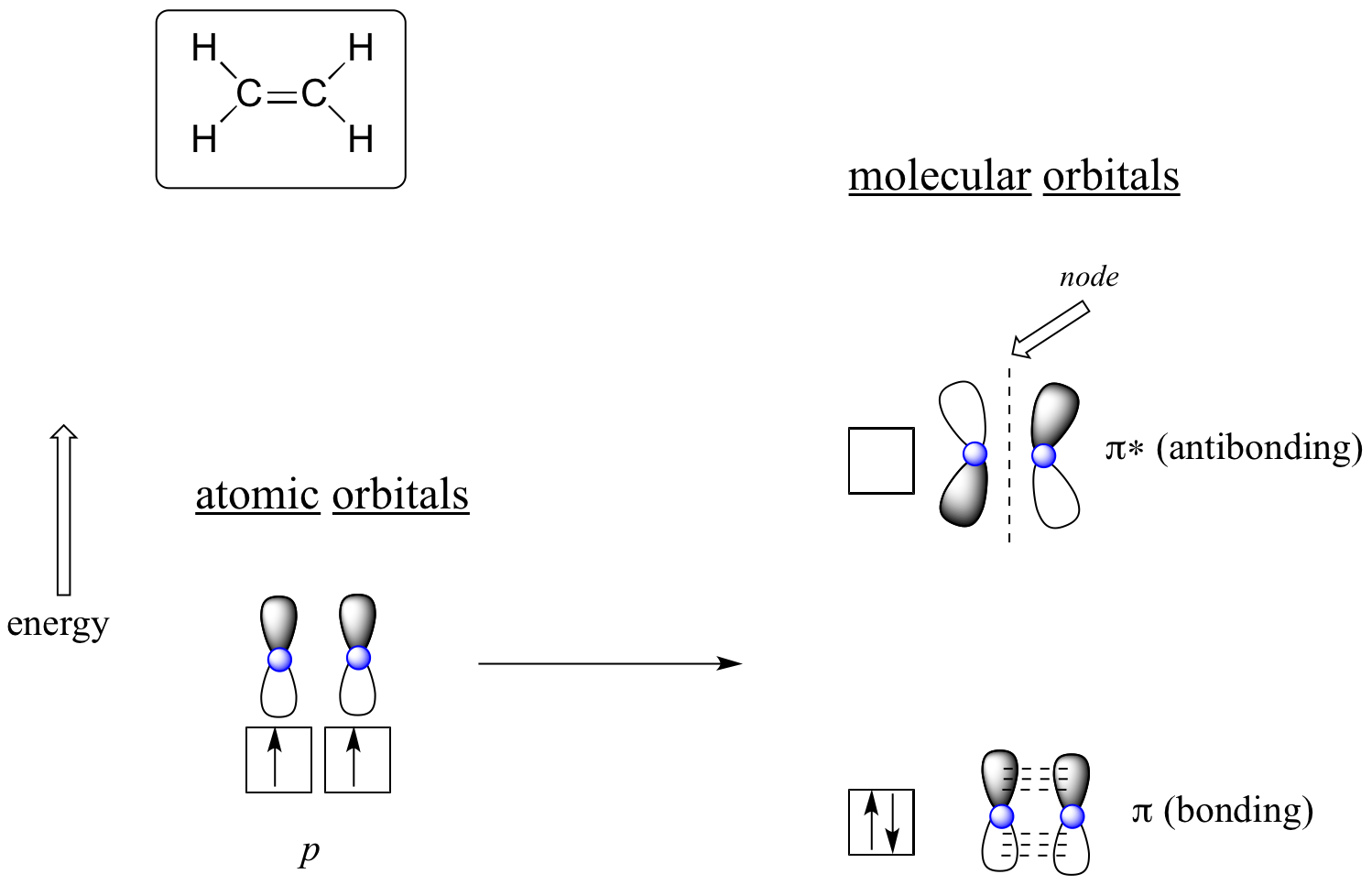
Orbitali molecolari per l’etene (etilene)
Nell’orbitale pi di legame, i due lobi ombreggiati degli orbitali p interagiscono costruttivamente tra loro, così come i due lobi non ombreggiati (ricordate, la scelta arbitraria dell’ombreggiatura rappresenta i segni matematici (+) e (-) della funzione d’onda matematica che descrive l’orbitale). C’è una maggiore densità di elettroni tra i due nuclei di carbonio nell’orbitale molecolare – è un’interazione di legame.
Nell’orbitale pi* antibonding a più alta energia, il lobo ombreggiato di un orbitale p interagisce distruttivamente con il lobo non ombreggiato del secondo orbitale p, portando a un nodo tra i due nuclei e alla repulsione generale tra i nuclei di carbonio.
Anche in questo caso, usando il principio dell'”accumulo”, mettiamo i due elettroni nell’orbitale molecolare pi a bassa energia e di legame. L’orbitale pi* anti-bonding rimane vuoto.
Prossimo, considereremo la molecola 1,3-butadiene. Dalla sola teoria degli orbitali di valenza potremmo aspettarci che il legame C2-C3 in questa molecola, essendo un legame sigma, possa ruotare liberamente.

Sperimentalmente, tuttavia, si osserva che c’è una barriera significativa alla rotazione sul legame C2-C3, e che l’intera molecola è planare. Inoltre, il legame C2-C3 è lungo 148 pm, più corto di un tipico legame carbonio-carbonio singolo (circa 154 pm), anche se più lungo di un tipico doppio legame (circa 134 pm).
La teoria degli orbitali molecolari spiega queste osservazioni con il concetto di legami pi delocalizzati. In questo quadro, i quattro orbitali atomici 2p si combinano matematicamente per formare quattro orbitali pi molecolari di energia crescente. Due di questi – gli orbitali pi di legame – sono più bassi in energia degli orbitali atomici p da cui sono formati, mentre due – gli orbitali pi* di anti-bonding – sono più alti in energia.

L’orbitale molecolare di energia più bassa, pi1, ha solo interazione costruttiva e zero nodi. Più alto in energia, ma ancora più basso degli orbitali p isolati, l’orbitale pi2 ha un nodo ma due interazioni costruttive – quindi è ancora un orbitale di legame nel complesso. Guardando i due orbitali anti-bonding, pi3* ha due nodi e una interazione costruttiva, mentre pi4* ha tre nodi e zero interazioni costruttive.
In base al principio di aufbau, i quattro elettroni degli orbitali atomici isolati 2pz sono collocati nei MO di legame pi1 e pi2. Poiché pi1 include l’interazione costruttiva tra C2 e C3, c’è un certo grado, nella molecola di 1,3-butadiene, di interazione pi-bonding tra questi due carboni, che spiega la sua lunghezza più corta e la barriera alla rotazione. L’immagine del legame di valenza dell’1,3-butadiene mostra i due legami pi come isolati l’uno dall’altro, con ogni coppia di elettroni pi “bloccati” nel proprio legame pi. Tuttavia, la teoria degli orbitali molecolari predice (accuratamente) che i quattro elettroni pi sono in qualche misura delocalizzati, o ‘sparsi’, sull’intero sistema pi.
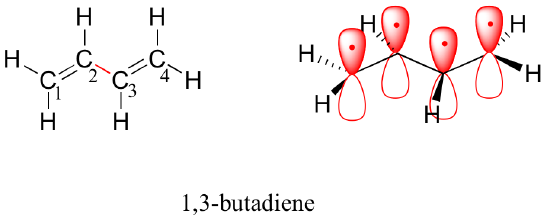
visualizzazione dello spazio
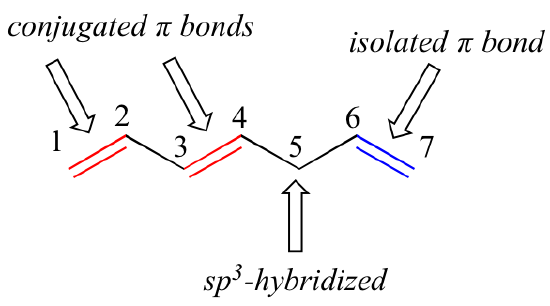
1,3-butadiene è il più semplice esempio di un sistema di legami pi coniugati. Per essere considerati coniugati, due o più legami pi devono essere separati da un solo legame – in altre parole, non ci può essere un carbonio sp3-ibrido intermedio, perché questo romperebbe il sistema sovrapposto di orbitali p paralleli. Nel composto qui sotto, per esempio, i doppi legami C1-C2 e C3-C4 sono coniugati, mentre il doppio legame C6-C7 è isolato dagli altri due legami pi da C5 sp3-ibrido.
Un concetto molto importante da tenere a mente è che c’è una stabilità termodinamica inerente associata alla coniugazione. Questa stabilità può essere misurata sperimentalmente confrontando il calore di idrogenazione di due diversi dieni. (L’idrogenazione è un tipo di reazione che impareremo molto di più nel capitolo 15: essenzialmente, è il processo di aggiunta di una molecola di idrogeno – due protoni e due elettroni – a un legame p). Quando i due doppi legami coniugati dell’1,3-pentadiene vengono “idrogenati” per produrre pentano, vengono rilasciati circa 225 kJ per mole di pentano formato. Confrontate questo dato con i circa 250 kJ/mol rilasciati quando i due doppi legami isolati dell’1,4-pentadiene vengono idrogenati, formando anch’essi pentano.
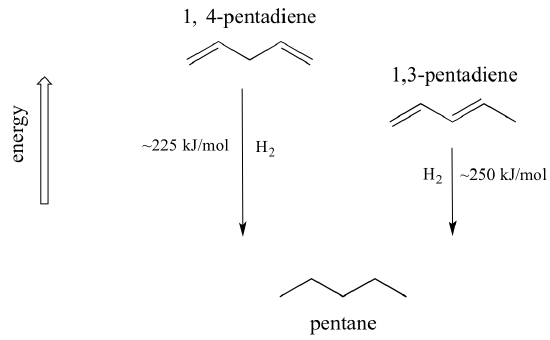
Il diene coniugato ha un’energia inferiore: in altre parole, è più stabile. In generale, i legami pi coniugati sono più stabili dei legami pi isolati.
I sistemi pi coniugati possono coinvolgere atomi di ossigeno e azoto oltre al carbonio. Nel metabolismo delle molecole di grasso, alcune delle reazioni chiave coinvolgono alcheni coniugati a gruppi carbonilici.

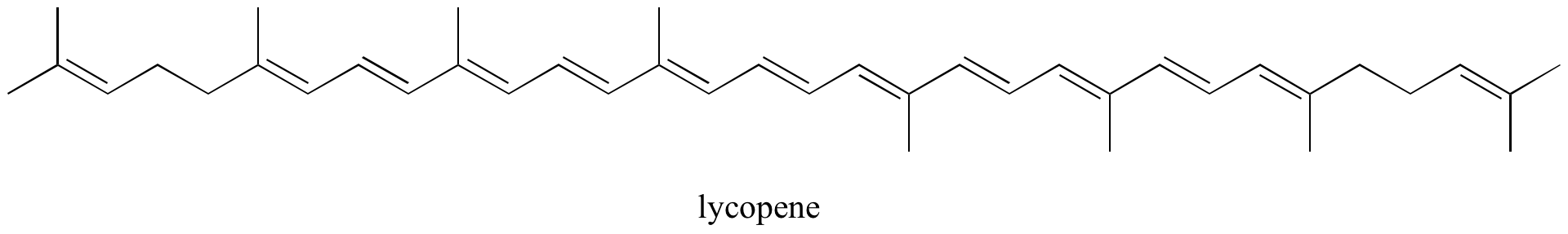
Nel capitolo 4, vedremo che la teoria MO è molto utile per spiegare perché le molecole organiche che contengono sistemi estesi di legami pi coniugati hanno spesso colori distinti. Il beta-carotene, il composto responsabile del colore arancione delle carote, ha un sistema esteso di 11 legami pi coniugati.
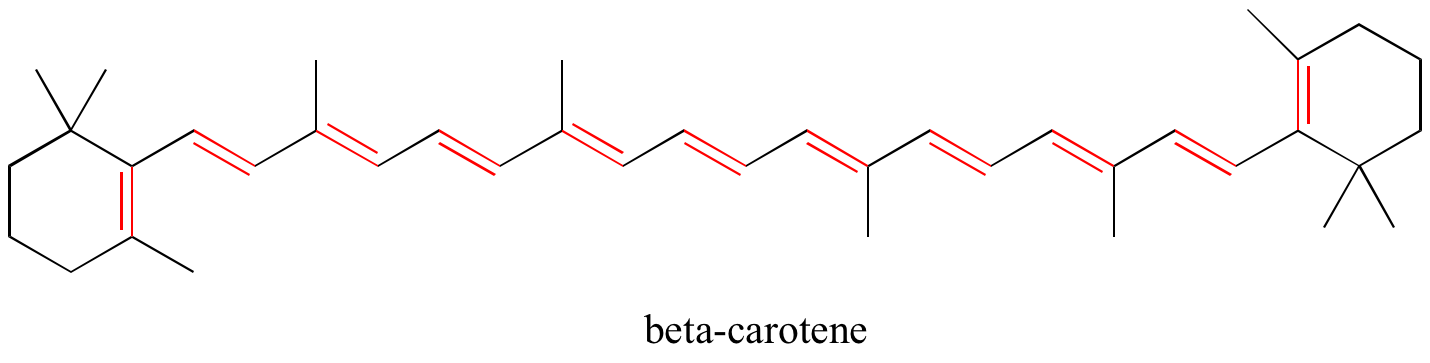
Esercizio: Identifica tutti i doppi legami coniugati e isolati nelle strutture seguenti. Per ogni sistema pi coniugato, specificare il numero di orbitali p sovrapposti e quanti elettroni pi sono condivisi tra loro.
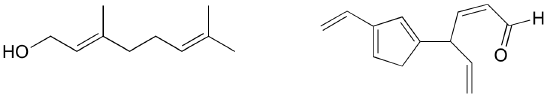
Esercizio: Identifica tutti i legami pi isolati e coniugati nel licopene, il composto di colore rosso dei pomodori. Quanti elettroni pi sono contenuti nel sistema pi coniugato?
Soluzioni agli esercizi
Aromaticità – Il sistema coniugato definitivo
La teoria degli orbitali molecolari è particolarmente utile per spiegare le proprietà uniche dei composti aromatici come il benzene:
Modello 3D interattivo del benzene
Anche se il benzene è più spesso disegnato con tre doppi legami e tre legami singoli, in realtà tutti i legami carbonio-carbonio sono esattamente della stessa lunghezza (138 pm). Inoltre, i legami pi nel benzene sono significativamente meno reattivi dei legami pi “normali”, sia isolati che coniugati. Qualcosa nella struttura del benzene rende la sua disposizione dei legami pi particolarmente stabile. Questo ‘qualcosa’ ha un nome: si chiama ‘aromaticità’.
Qual è esattamente questa proprietà ‘aromatica’ che rende i legami pi nel benzene così stabili? In gran parte, la risposta a questa domanda sta nel fatto che il benzene è una molecola ciclica in cui tutti gli atomi dell’anello sono sp2-ibridizzati. Questo permette agli elettroni pi di essere delocalizzati in orbitali molecolari che si estendono tutto intorno all’anello, sopra e sotto il piano. Perché questo accada, naturalmente, l’anello deve essere planare – altrimenti gli orbitali p non potrebbero sovrapporsi correttamente. Il benzene è infatti noto per essere una molecola piatta.
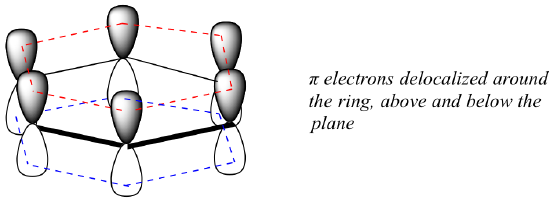
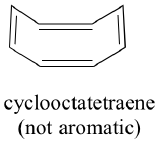
Tutte le molecole cicliche con alternanza di legami singoli e doppi hanno questa stessa stabilità aromatica? La risposta, in effetti, è “no”. L’anello di cicloottatetraene a otto membri mostrato qui sotto non è piatto, e i suoi legami π reagiscono come gli alcheni “normali”.
E’ chiaro che ci vuole qualcosa di più per essere aromatici, e questo può essere spiegato meglio con la teoria degli orbitali molecolari. Guardiamo un diagramma energetico degli orbitali molecolari pi nel benzene.
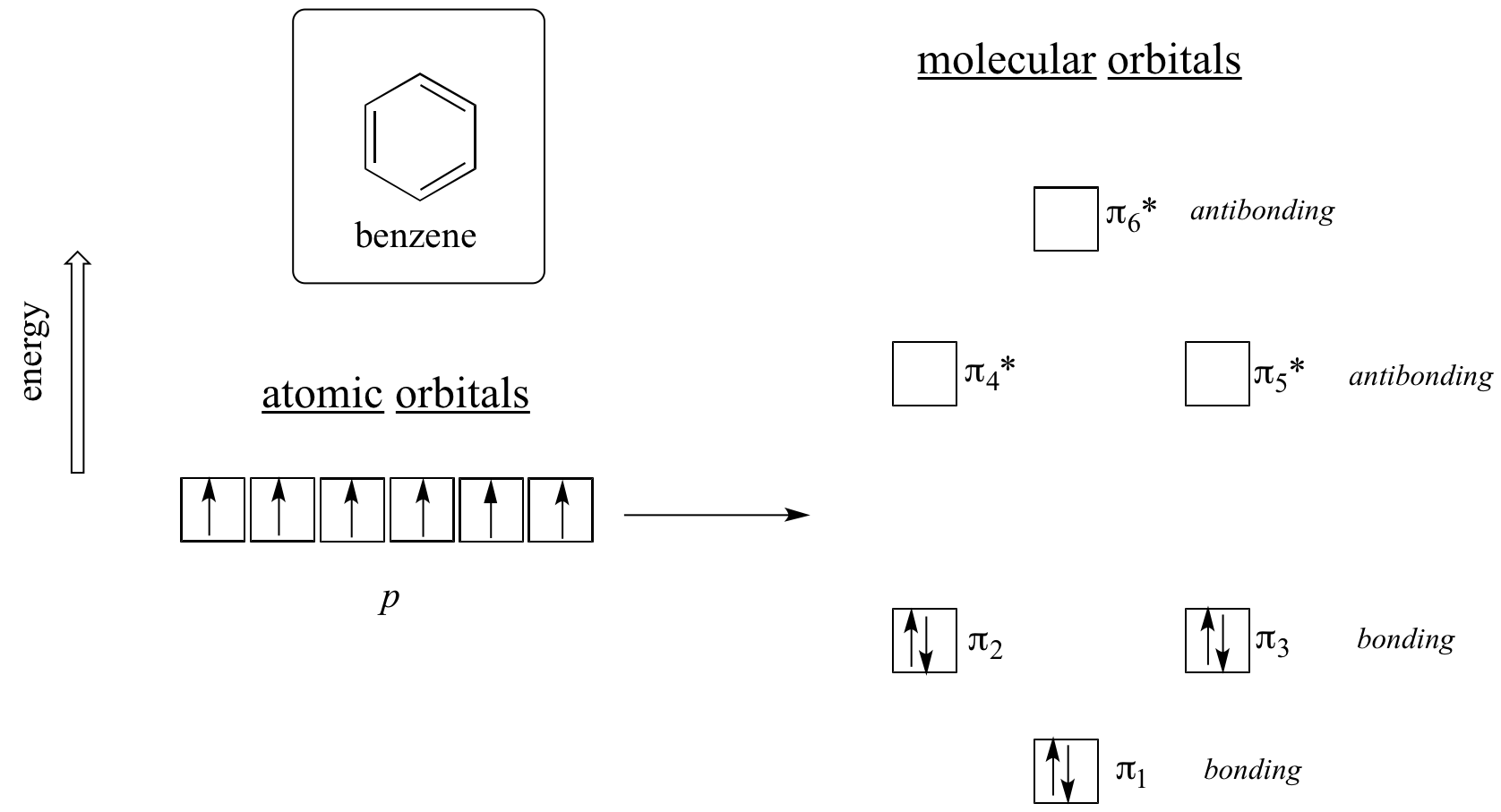
I calcoli di meccanica quantistica ci dicono che i sei orbitali molecolari pi nel benzene, formati da sei orbitali p atomici, occupano quattro livelli energetici separati. pi1 e pi6* hanno livelli energetici unici, mentre le coppie pi2 – pi3 e pi4*- pi5* sono degenerate, cioè sono allo stesso livello energetico. Quando usiamo il principio di aufbau per riempire questi orbitali con i sei elettroni pi nel benzene, vediamo che gli orbitali di legame sono completamente riempiti, e gli orbitali di anti legame sono vuoti. Questo ci dà un buon indizio sull’origine della speciale stabilità del benzene: un set completo di MO di legame è simile in molti modi al ‘guscio completo’ di elettroni negli orbitali atomici dei gas nobili stabili elio, neon e argon.
Ora, facciamo la stessa cosa per il cicloottatetraene, che abbiamo già imparato che non è aromatico.
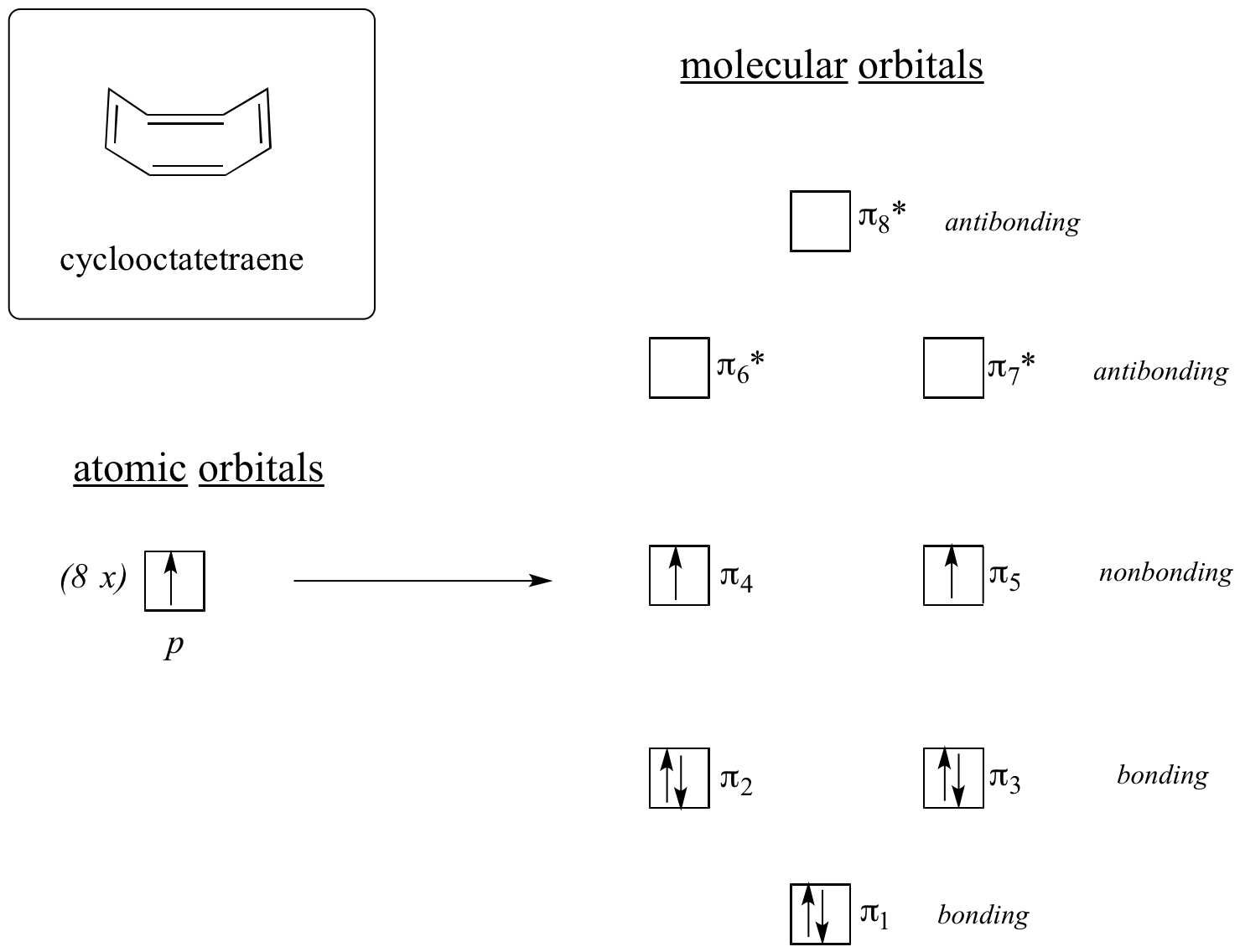
Il risultato dei calcoli degli orbitali molecolari ci dice che i MO più bassi e più alti (pi1 e pi8*) hanno livelli energetici unici, mentre gli altri sei formano coppie degenerate. Notate che pi4 e pi5 sono allo stesso livello energetico degli orbitali atomici 2pz isolati: questi non sono quindi né leganti né antileganti, ma vengono definiti MO non leganti. Riempiendo i MO con gli otto elettroni pi della molecola, troviamo che gli ultimi due elettroni sono spaiati e cadono nei due orbitali degeneri di non legame. Poiché non abbiamo un guscio perfettamente riempito di MO di legame, la nostra molecola non è aromatica. Di conseguenza, ciascuno dei doppi legami nel cicloottatetraene si comporta più come un doppio legame isolato.
Per ora, l’obiettivo di apprendimento importante è riconoscere i sistemi di legami pi coniugati e capire che il benzene è eccezionalmente stabile e presenta una proprietà chiamata aromaticità. L’aromaticità e la chimica dei composti aromatici è relativamente complessa e viene discussa più in dettaglio nei capitoli successivi di questo testo.
Organic Chemistry With a Biological Emphasis di Tim Soderberg (University of Minnesota, Morris)