Elettronegatività e polarità del legame
Anche se abbiamo definito il legame covalente come condivisione di elettroni, gli elettroni in un legame covalente non sono sempre condivisi equamente dai due atomi legati. A meno che il legame colleghi due atomi dello stesso elemento, come in H2, ci sarà sempre un atomo che attrae gli elettroni nel legame più fortemente dell’altro atomo, come in HCl, mostrato nella figura \(\PageIndex{1}}). Un legame covalente che ha un’uguale condivisione di elettroni (Figura \PageIndex{1a}) è chiamato un legame covalente non polare. Un legame covalente che ha una condivisione ineguale di elettroni, come nella figura \PageIndex{1b}}, è chiamato un legame covalente polare.

La distribuzione della densità di elettroni in un legame polare non è uniforme. È maggiore intorno all’atomo che attira gli elettroni più dell’altro. Per esempio, gli elettroni nel legame H-Cl di una molecola di cloruro di idrogeno passano più tempo vicino all’atomo di cloro che a quello di idrogeno. Nota che l’area ombreggiata intorno a Cl nella figura (\PageIndex{1b}) è molto più grande di quella intorno a H.
Questo squilibrio nella densità di elettroni risulta in un accumulo di parziale carica negativa (designata come δ-) su un lato del legame (Cl) e una parziale carica positiva (designata δ+) sull’altro lato del legame (H). Questo si vede nella figura \(\PageIndex{2a}). La separazione di carica in un legame covalente polare risulta in un dipolo elettrico (due poli), rappresentato dalla freccia nella figura \(\PageIndex{2b}). La direzione della freccia è rivolta verso l’estremità δ- mentre la coda + della freccia indica l’estremità δ+ del legame.
Figura \(\PageIndex{2}}): (a) La condivisione ineguale della coppia di elettroni di legame tra H e Cl porta a una parziale carica positiva sull’atomo di H e una parziale carica negativa sul Cl. I simboli δ+ e δ- indicano la polarità del legame H-Cl. (b) Il dipolo è rappresentato da una freccia con una croce in coda. La croce è vicina all’estremità δ+ e la punta della freccia coincide con il δ-.
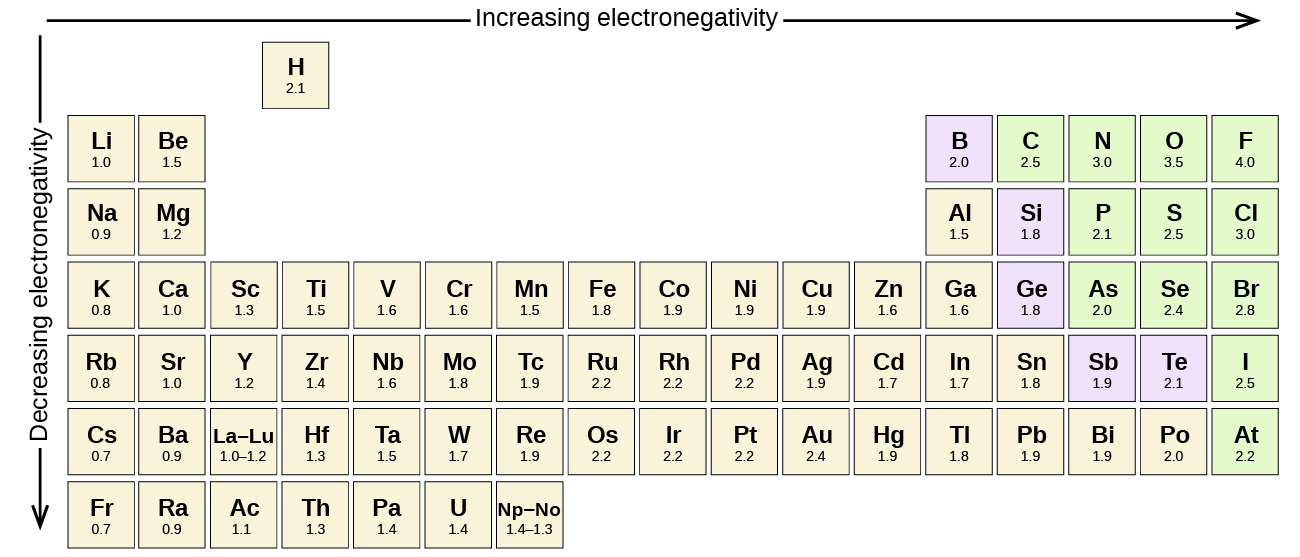
Ogni legame covalente tra atomi di elementi diversi è un legame polare, ma il grado di polarità varia ampiamente. Alcuni legami tra elementi diversi sono solo minimamente polari, mentre altri sono fortemente polari. I legami ionici possono essere considerati il massimo della polarità, con elettroni trasferiti piuttosto che condivisi. Per giudicare la polarità relativa di un legame covalente, i chimici usano l’elettronegatività, che è una misura relativa di quanto fortemente un atomo attrae elettroni quando forma un legame covalente. Ci sono varie scale numeriche per valutare l’elettronegatività. La figura \(\PageIndex{3}) mostra una delle più popolari: la scala di Pauling.
Guardando più da vicino: Linus Pauling
Forse il chimico più influente del XX secolo, Linus Pauling (1901-94) è l’unica persona ad aver vinto due premi Nobel individuali (cioè non condivisi). Negli anni ’30, Pauling utilizzò nuove teorie matematiche per enunciare alcuni principi fondamentali del legame chimico. Il suo libro del 1939 The Nature of the Chemical Bond è uno dei libri più significativi mai pubblicati in chimica.
Dal 1935, l’interesse di Pauling si rivolse alle molecole biologiche, e gli fu assegnato il premio Nobel per la chimica del 1954 per il suo lavoro sulla struttura delle proteine. (Era molto vicino a scoprire la struttura a doppia elica del DNA quando James Watson e James Crick annunciarono la loro scoperta della struttura nel 1953). In seguito gli fu assegnato il premio Nobel per la pace del 1962 per i suoi sforzi per vietare i test sulle armi nucleari.

Linus Pauling fu uno dei chimici più influenti del 20° secolo.
Negli ultimi anni, Pauling si convinse che grandi dosi di vitamina C avrebbero prevenuto le malattie, compreso il comune raffreddore. La maggior parte delle ricerche cliniche non riuscì a mostrare una connessione, ma Pauling continuò a prenderne grandi dosi ogni giorno. Morì nel 1994, dopo aver trascorso una vita a stabilire un’eredità scientifica che pochi eguaglieranno mai.
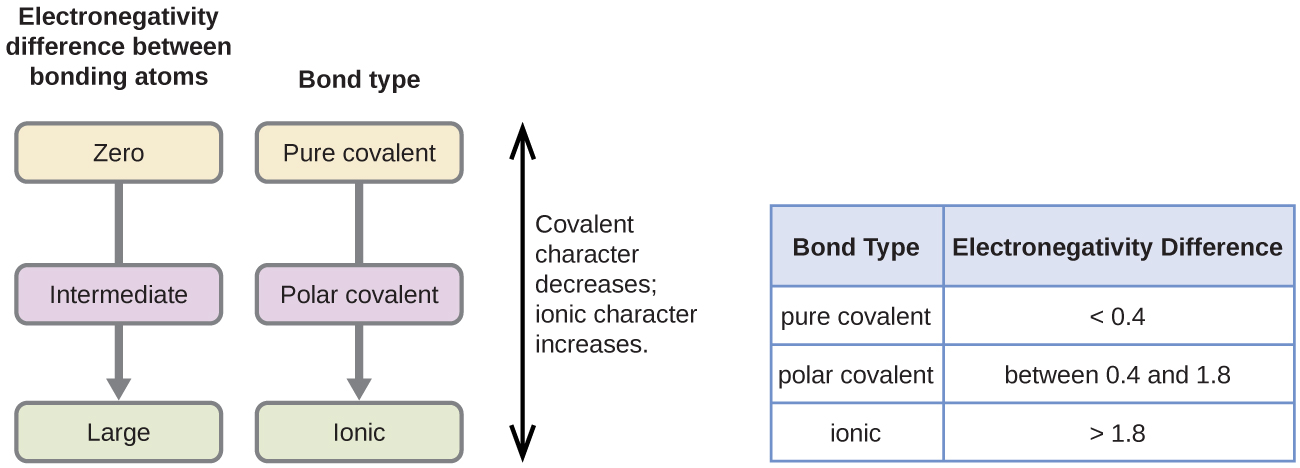
La polarità di un legame covalente può essere giudicata determinando la differenza nelle elettronegatività dei due atomi che creano il legame. Maggiore è la differenza di elettronegatività, maggiore è lo squilibrio di condivisione degli elettroni nel legame. Anche se non ci sono regole ferree, la regola generale è che se la differenza di elettronegatività è inferiore a circa 0,4, il legame è considerato non polare; se la differenza è maggiore di 0,4, il legame è considerato polare. Se la differenza di elettronegatività è abbastanza grande (generalmente maggiore di circa 1,8), il composto risultante è considerato ionico piuttosto che covalente. Una differenza di elettronegatività di zero, ovviamente, indica un legame covalente non polare.
Esempio \(\PageIndex{1})
Descrivere la differenza di elettronegatività tra ogni coppia di atomi e la conseguente polarità (o tipo di legame).
- C e H
- H e H
- Na e Cl
- O e H
Soluzione
- Il carbonio ha un’elettronegatività di 2,5, mentre il valore dell’idrogeno è 2,1. La differenza è di 0,4, che è piuttosto piccola. Il legame C-H è quindi considerato non polare.
- Entrambi gli atomi di idrogeno hanno lo stesso valore di elettronegatività-2,1. La differenza è zero, quindi il legame è nonpolare.
- L’elettronegatività del sodio è 0,9, mentre quella del cloro è 3,0. La differenza è 2,1, che è piuttosto alta, e così il sodio e il cloro formano un composto ionico.
- Con 2,1 per l’idrogeno e 3,5 per l’ossigeno, la differenza di elettronegatività è 1,4. Ci aspetteremmo un legame molto polare. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.