Introduzione
Il legame ionico è il trasferimento completo di elettroni di valenza tra atomi. È un tipo di legame chimico che genera due ioni di carica opposta. Nei legami ionici, il metallo perde elettroni per diventare un catione carico positivamente, mentre il non metallo accetta quegli elettroni per diventare un anione carico negativamente. I legami ionici richiedono un donatore di elettroni, spesso un metallo, e un accettore di elettroni, un non metallo.
Il legame ionico si osserva perché i metalli hanno pochi elettroni nei loro orbitali più esterni. Perdendo questi elettroni, questi metalli possono raggiungere la configurazione di gas nobile e soddisfare la regola dell’ottetto. Allo stesso modo, i non metalli che hanno quasi 8 elettroni nei loro gusci di valenza tendono ad accettare facilmente elettroni per raggiungere la configurazione di gas nobile. Nel legame ionico, più di 1 elettrone può essere donato o ricevuto per soddisfare la regola dell’ottetto. Le cariche dell’anione e del catione corrispondono al numero di elettroni donati o ricevuti. Nei legami ionici, la carica netta del composto deve essere zero.
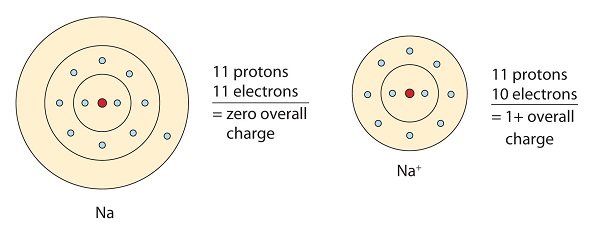
Questa molecola di sodio dona l’elettrone solitario nel suo orbitale di valenza per ottenere la configurazione a ottetto. Questo crea un catione carico positivamente a causa della perdita dell’elettrone.
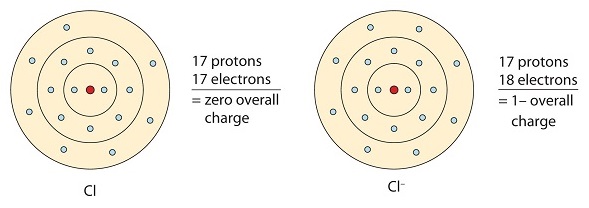
Questo atomo di cloro riceve un elettrone per raggiungere la sua configurazione ad ottetto, che crea un anione carico negativamente.
L’energia complessiva prevista del processo di legame ionico, che include l’energia di ionizzazione del metallo e l’affinità elettronica del non metallo, è solitamente positiva, indicando che la reazione è endotermica e sfavorevole. Tuttavia, questa reazione è altamente favorevole a causa dell’attrazione elettrostatica tra le particelle. Alla distanza interatomica ideale, l’attrazione tra queste particelle rilascia abbastanza energia per facilitare la reazione. La maggior parte dei composti ionici tende a dissociarsi in solventi polari perché sono spesso polari. Questo fenomeno è dovuto alle cariche opposte su ogni ione.
Esempio \(\PageIndex{1}): Sali di cloruro
.jpg?revision=2)
In questo esempio, l’atomo di sodio sta donando il suo 1 elettrone di valenza all’atomo di cloro. Questo crea un catione di sodio e un anione di cloro. Notate che la carica netta del composto risultante è 0.
.jpg?revision=2)
In questo esempio, l’atomo di magnesio sta donando entrambi i suoi elettroni di valenza agli atomi di cloro. Ogni atomo di cloro può accettare solo 1 elettrone prima di poter raggiungere la sua configurazione di gas nobile; quindi, sono necessari 2 atomi di cloro per accettare i 2 elettroni donati dal magnesio. Notice that the net charge of the compound is 0.