


Tabella dei contenuti
Patofisiologia della PCOS
Criteri diagnostici
Resistenza all’insulina e resistenza alla leptina
Autori
Molti di noi non si rendono conto di quanto bene funzioni l’intricato sistema di cicli di feedback nel nostro sistema endocrino riproduttivo finché non vengono in qualche modo interrotti. La sindrome dell’ovaio policistico (PCOS) rappresenta un esempio di questo. Si tratta di un disturbo caratterizzato da un insieme di sintomi, ed è prevalente nei pazienti che si presentano alle cliniche di infertilità, colpendo il 5-10% delle donne in età riproduttiva. Si stima che il 90% dei casi di anovulazione siano legati alla PCOS. Oltre a influenzare negativamente i parametri metabolici e l’ovulazione, è anche associata a diversi problemi di salute mentale (come la depressione e l’ansia) nelle donne che la hanno. Nella parte 1, discuteremo la fisiopatologia della PCOS, i suoi criteri diagnostici e la resistenza all’insulina e alla leptina. Nella parte 2, affronteremo la gestione della PCOS, le implicazioni psicologiche e il ruolo unico del medico nel sostenere la paziente con PCOS.
Patofisiologia della PCOS
Nelle donne ovulatorie, sotto l’influenza di un asse ipotalamo-ipofisi-ovaio (HPO) correttamente funzionante, il ciclo mestruale è caratterizzato dalla crescita e dallo sviluppo di (solitamente) un singolo follicolo che viene estratto dalla coorte (gruppo di follicoli) di quel mese. In risposta alla stimolazione GnRH, l’ipofisi anteriore secerne due importanti gonadotropine: L’ormone follicolo stimolante (FSH) e l’ormone luteinizzante (LH). L’FSH agisce sull’ovaio per aiutare la crescita e la maturazione di piccoli follicoli. Il follicolo dominante di quel mese è quello che ha acquisito più recettori FSH. Questo follicolo continuerà a crescere e a maturare a spese dei restanti piccoli follicoli, che poi vengono riassorbiti dal corpo (ma vengono comunque dedotti dalla riserva totale di ovuli della donna). La crescita del follicolo dominante genera la produzione di estradiolo ed elevati livelli di estrogeni segnalano la cessazione della produzione di FSH attraverso un sistema di feedback negativo, ma un livello di estrogeni elevato e sostenuto innescherà un picco di LH che provoca l’ovulazione.
In una donna con PCOS l’asse HPO non esprime una funzionalità normale. L’ormone pulsatile GnRH è alterato, con conseguente aumento dell’attività dell’LH da parte dell’ipofisi. Questo aumento dell’LH aumenta la stimolazione delle cellule theca (vedi fig. 1), che producono androstenedione e testosterone, due androgeni, e il conseguente ambiente iperandrogenico dell’ovaio preclude la normale crescita follicolare, la maturazione e l’ovulazione. L’ovaio, quindi, diventa composto da molti piccoli follicoli antrali che non diventano mai dominanti. La raccolta di questi follicoli può causare un aumento delle dimensioni delle ovaie e generare un livello sierico di estrogeni leggermente elevato. Rimane sconosciuto il motivo per cui si verifica la PCOS e chi la colpisce, ma si pensa che la genetica e i fattori ambientali abbiano una complessa interazione nella sua comparsa e nelle sue manifestazioni cliniche.
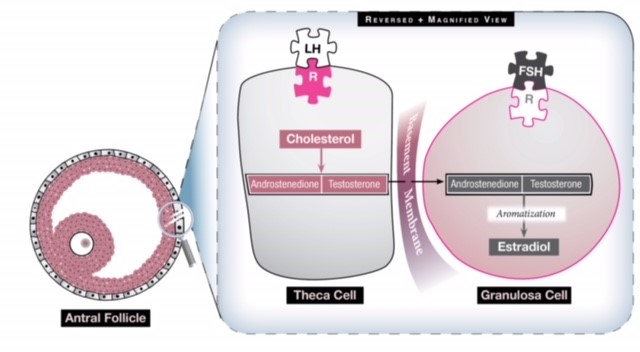
Fig 1: Ci sono due cellule nell’ovaio che contribuiscono alla produzione di estrogeni e lavorano sinergicamente. La cellula theca converte il colesterolo in due androgeni (androstenedione e testosterone) sotto l’influenza di LH. Questi androgeni viaggiano poi attraverso la membrana basale nella cellula granulosa che, sotto l’influenza dell’FSH, li converte in estrogeni attraverso un processo chiamato aromatizzazione. L’eccesso di stimolazione dell’LH, quindi, genererà più androgeni di quelli che possono essere convertiti in estrogeni, quindi il livello di estrogeni non diventa mai abbastanza elevato da generare un picco di LH e l’ovaio ha un ambiente iperandrogenico.
Criteri diagnostici
La PCOS non è definita o diagnosticata da un semplice sintomo ed è spesso una diagnosi di esclusione per le donne che hanno oligo-ovulazione e iperandrogenismo evidenceof (come l’acne alopecia e irsutismo (maschile-crescita dei capelli e consistenza) una volta che altri disturbi sono esclusi. Colpisce le donne di tutte le forme, dimensioni e background. Anche se i sintomi possono iniziare al menarca, la maggior parte dei medici sono riluttanti a diagnosticare un adolescente con PCOS relativamente recente mestruazioni come irregolarità del ciclo mestruale è normale nel primo anno postmenarca e può risolvere nel tempo. I criteri diagnostici più comunemente usati oggi sono stati rivisti in un workshop di esperti internazionali a Rotterdam, Paesi Bassi, nel 2003 e sono chiamati i Criteri di Rotterdam, dove sono stati stabiliti i seguenti: La PCOS può essere diagnosticata solo quando una paziente ha almeno due delle tre caratteristiche: oligo/anovulazione, iperandrogenismo (biochimico o clinico), e la comparsa di ovaie policistiche all’ecografia; l’iperandrogenismo è diagnosticato clinicamente (dal clinico che osserva i sintomi androgeni) o biochimicamente (come i livelli elevati di testosterone libero nel siero).
Questi criteri sono stati rivisti nel 2018 da un comitato internazionale che ha apportato alcuni cambiamenti. In primo luogo, a causa della disponibilità di macchine ecografiche transvaginali sensibili, l’ovaromorfologia policistica (PCOM) è caratterizzata dalla presenza di 20 o più follicoli (<10 mm) in entrambe le ovaie o un volume ovarico ≥ 10 ml in entrambe le ovaie, come visto dall’ecografia transvaginale, spesso situato intorno alla periferia dell’ovaio (o delle ovaie). Le linee guida del 2018 affermano anche che se una donna ha cicli mestruali irregolari e iperandrogenismo, l’ecografia non è necessaria per la diagnosi, anche se molti medici preferiscono ancora eseguirla. I livelli di ormone anti-mulleriano (AMH) sono spesso elevati nelle pazienti PCOS, anche se questo non è specifico per la PCOS come livelli elevati possono essere trovati in donne senza la condizione. Nelle donne affette da PCOS, un livello elevato di AMH riflette un maggior numero di follicoli arrestati nelle fasi pre-antrale e antrale che non riescono ad ovulare.
Altre condizioni che possono causare cicli mestruali irregolari (gravidanza, ipo- e ipertiroidismo, insufficienza ovarica e iperprolattinemia) e iperandrogenismo (iperplasia surrenalica congenita, tumore surrenale e tumore che secerne androgeni) devono essere escluse prima, quindi, oltre ai livelli sierici di bHCG, vengono prelevati i livelli basali di FSH e LH, l’ormone tireostimolante (TSH), la prolattina, il testosterone totale e libero, il 17idrossiprogesterone (17OHP), il deidroepiandrosterone solfato (DHEAS). Una delle diagnosi differenziali più difficili è discernere una donna con amenorrea funzionale ipotalamica (FHA) rispetto a una donna magra con PCOS. Classicamente le donne con FHA hanno un BMI basso, ma può anche essere nel range basso/normale. Entrambe le condizioni sono caratterizzate da anovulazione e ovaie che sembrano avere molti piccoli follicoli in uno stato di riposo. Mentre l’iperandrogenismo non è una componente della FHA, le donne con questa condizione possono avere irsutismo a causa della loro etnia, confondendo ulteriormente il quadro clinico. Un modo per distinguere la FHA dalla PCOS è l’esame del sangue e l’esame ecografico. Le donne con FHA spesso hanno livelli di FSH e LH basali da bassi a normali (a causa dell’iperstimolazione delle ovaie) e un basso livello di estrogeni, mentre le donne con PCOS hanno tipicamente livelli sierici di LH elevati e livelli di FSH da bassi a normali. All’ecografia, l’utero e le ovaie delle donne con FHA sono piccole o piccole/normali, mentre le donne con PCOS hanno tipicamente un volume ovarico aumentato (>10 ml). C’è una ricerca emergente su una possibile connessione tra FHA e PCOS poiché non tutte le donne presentano le caratteristiche di entrambe le condizioni e FHA e PCOS hanno alcune caratteristiche sovrapposte.
Resistenza all’insulina e resistenza alla leptina
Anche se la diagnosi di resistenza all’insulina (IR) non fa parte dei criteri di Rotterdam, è molto diffusa nelle donne con PCOS. Un BMI elevato aumenta la possibilità che una donna con PCOS abbia una IR, ma anche le donne non obese con PCOS hanno molte più probabilità delle loro controparti senza PCOS di sviluppare resistenza all’insulina. Oltre alle conseguenze sulla salute dell’IR (come la sindrome metabolica e il diabete mellito di tipo 2), esacerba e contribuisce anche all’iperandrogenismo in una popolazione di pazienti che già ne soffre.
Il gold standard per diagnosticare l’insulino-resistenza è utilizzare un clamp euglicemico iperinsulinemico, un test che deve essere eseguito in un ambiente ospedaliero. Per la maggior parte, questo è irragionevole, quindi si fa un test indiretto per l’IR. Nelle donne con PCOS in ambiente clinico apreconception, il suggerimento è quello di eseguire un test di tolleranza al glucosio orale (OGTT) dato l’alto rischio delle donne con PCOS di sviluppare alterata tolleranza al glucosio e diabete gestazionale in gravidanza. Anche se richiede un po’ di tempo, questo test è preferito rispetto al glucosio plasmatico a digiuno e ai soli livelli di insulina in quanto può diagnosticare l’alterata tolleranza al glucosio in una fase più precoce.Nelle donne con PCOS che non sono in una categoria ad alto rischio (cioè, BMI<25 kg/m2, non cercano di concepire, nessuna storia personale o familiare di alterata tolleranza al glucosio) ottenere almeno i livelli di base di glucosio a digiuno, insulina ed emoglobinaA1c può essere utile per ottenere una “fotografia” dello stato glicemico del paziente.
Quando una donna ha la PCOS, essere in sovrappeso o obesa intensifica le conseguenze metaboliche. I globuli bianchi sono metabolicamente attivi. Ad un livello normale, sono protettivi in quanto forniscono una casa sicura per i lipidi e tengono il grasso fuori dagli organi. Quando ci sono troppe cellule grasse, possono essere sovraccaricate e scoppiare, rilasciando acidi grassi nel flusso sanguigno che possono influenzare ogni organo. Queste cellule di grasso si “incastrano” tra le cellule degli organi e li rendono rigidi, danneggiati, meno funzionali e causano un’infiammazione cronica. Non è raro diagnosticare il ‘fegato grasso’ in una donna con PCOS che è obesa, poiché il fegato è particolarmente vulnerabile. Inoltre, un eccesso di adiposità può perpetuare l’iperinsulinemia e l’insulino-resistenza esistenti, alterando il delicato equilibrio di citochine e ormoni prodotti dal tessuto adiposo (vedi Figura 2), per esempio, diminuendo la produzione di citochine che aumentano la sensibilità all’insulina e aumentando quelle che promuovono l’infiammazione e l’insulino-resistenza. L’insulina in eccesso contribuisce ulteriormente all’adiposità addominale e all’iperandrogenismo creando un circolo vizioso nelle pazienti PCOS che può essere difficile da superare.
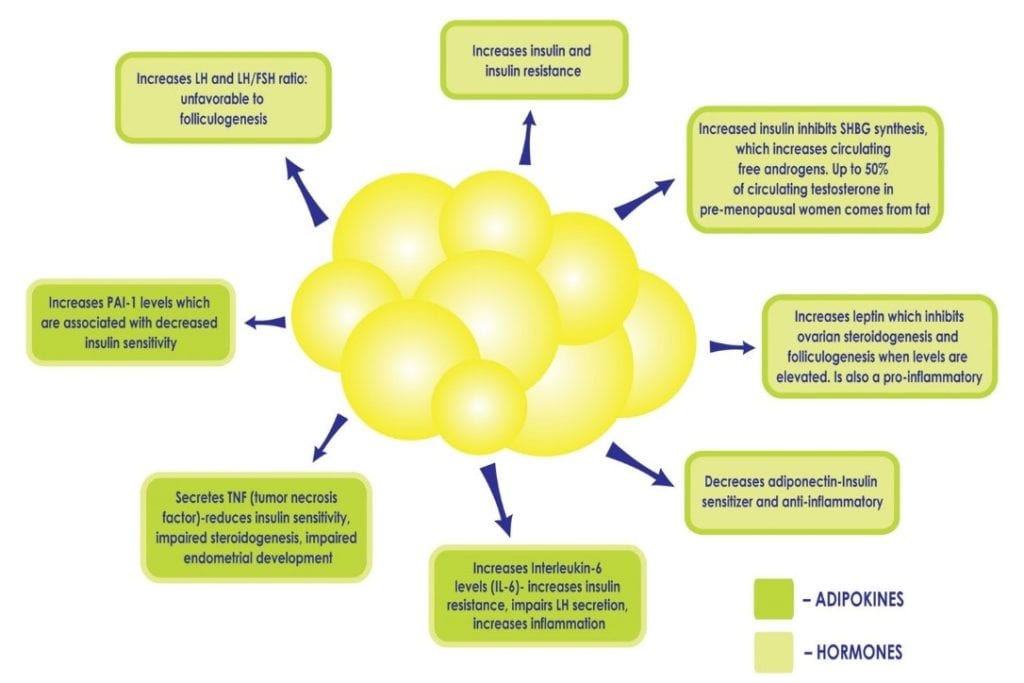
Figura 2: L’aumento dell’adiposità, e il conseguente aumento delle cellule adipose, può perpetuare l’iperinsulinemia e l’insulino-resistenza interrompendo il delicato equilibrio degli ormoni prodotti dal tessuto adiposo, come la diminuzione della produzione di adiponectina, una citochina che aumenta la sensibilità all’insulina e l’aumento di altre che promuovono l’infiammazione.
Oltre alla resistenza all’insulina, i pazienti con PCOS e obesità possono anche soffrire di quella che alcuni definiscono resistenza alla leptina. Alcuni studi hanno dimostrato che i livelli di leptina sono più alti nelle pazienti obese con PCOS rispetto alle pazienti magre. La leptina è una proteina prodotta dal tessuto adiposo che regola l’equilibrio energetico e l’appetito del corpo. Quando funziona correttamente, un aumento della leptina segnala al cervello di ridurre l’appetito di una persona e una diminuzione della leptina fa il contrario, segnala al cervello di aumentare l’appetito per fornire il carburante necessario per l’energia. In molte pazienti PCOS con obesità, tuttavia, questo sistema è difettoso e, nonostante l’aumento delle concentrazioni di leptina secondario all’aumento del tessuto adiposo, l’efficacia della leptina diminuisce, portando alla resistenza alla leptina. La resistenza alla leptina è considerata un importante fattore di rischio per la patogenesi del sovrappeso e dell’obesità, poiché il corpo rimane insensibile a livelli elevati e segnala alla donna che ha ancora fame/non è sazia anche dopo aver mangiato. Molte donne con PCOS si lamentano di “non sentirsi mai sazie” a causa di questa resistenza e continuano a mangiare, portando ad un aumento del tessuto adiposo, che si traduce in una maggiore resistenza alla leptina e perpetua questo ciclo dannoso. Di conseguenza, le condizioni di sovrappeso e obesità sono comuni nelle donne con PCOS e la perdita di peso può sembrare impossibile poiché il mangiare intuitivo non è efficace quando gli spunti di fame e sazietà sono inaffidabili.
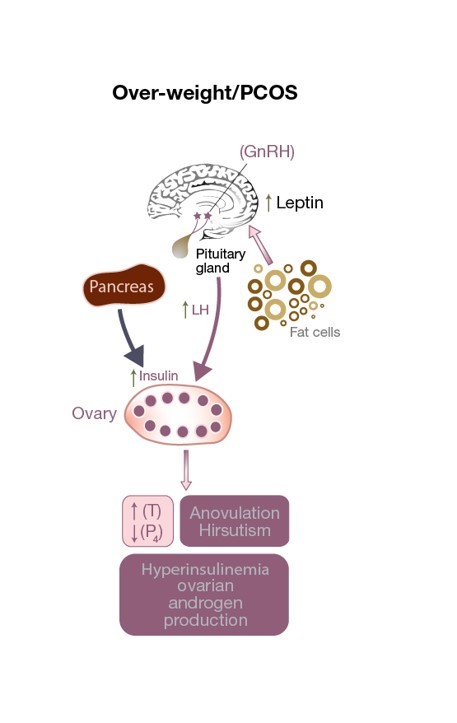
Figura 3: Interruzione dell’asse HPO in una paziente PCOS. C’è un eccesso di stimolazione dell’LH sulla cellula theca con conseguente aumento dei livelli di testosterone, un ambiente ovarico androgenico e anovulazione (con conseguenti bassi livelli di progesterone). L’aumento dei livelli di leptina dovuto a un eccesso di cellule adipose influisce sulla secrezione di GnRH. I livelli elevati di insulina contribuiscono all’iperandrogenismo.
L’alterata secrezione di leptina non solo influenza il peso corporeo, ma può avere un effetto negativo sull’ovulazione (vedi Fig 3) e persino sulla fecondazione in pazienti PCOS normopeso. Altera il rilascio di GnRH dall’ipotalamo, diminuendo la stimolazione dell’ipofisi anteriore (e quindi la secrezione diFSH e LH), e impedendo lo sviluppo di un ovocita maturo. Inoltre, le granulosacellule immagazzinano e producono anche leptina, e alti livelli di leptindecrementano la loro capacità di aromatizzazione che alla fine interferisce con la capacità di unfollicolo dominante di produrre quantità adeguate di estrogeni (vedi Fig 1). Un piccolo studio osservazionale ha trovato una correlazione diretta tra la concentrazione di leptina trovata nel fluido follicolare (FF-leptina) (che è stata correlata con il tasso di fecondazione) in donne magre con PCOS che si sono sottoposte a FIVET, rispetto a donne normovulanti e con peso uguale.
Autori
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Un ringraziamento speciale a NeilChappell, MD per la sua assistenza nella redazione di questo articolo.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter ”



![]()