1. Panoramica sulla segnalazione di Erk
La via della chinasi regolata dal segnale extracellulare (ERK) è una delle principali cassette di segnalazione della via di segnalazione della proteina chinasi attivata da mitogeno (MAPK). La cascata ERK è attivata da una varietà di agenti extracellulari, tra cui fattori di crescita, ormoni e anche stress cellulari per indurre processi cellulari che includono principalmente la proliferazione e la differenziazione, ma in alcune condizioni anche la risposta allo stress e altri. I principali componenti della MAPK/ERK chinasi (MEKK) sono i membri della famiglia Raf, Raf-1, A-Raf e B-Raf che fosforilano due residui di serina sui componenti della MAPK/ERK chinasi (MEK) MEK1/2. ERK1/2 sono responsabili della stimolazione degli effettori a valle, molti dei quali sono fattori di trascrizione. Uno dei principali fattori di trascrizione è la proteina legante l’elemento di risposta AMP ciclico (CREB).
Questa via ERK contribuisce al controllo di un gran numero di processi cellulari:
– Regolazione della proliferazione cellulare come l’attivazione delle cellule T
– Plasticità sinaptica come ilPotenziamento a lungo termine (LTP) nei neuroni dell’ippocampo
– Proliferazione delle cellule endoteliali durante l’angiogenesi
– Fosforilazione del fattore di trascrizione p53
– Il rimodellamento della via di segnalazione ERK può contribuire allo sviluppo della malattia policistica del rene
– Attivazione della fosfolipasi A2 (PLA2) nei mastociti.
2. Cascata di segnalazione di Erk
L’attivazione della cascata ERK1/2 è per lo più avviata ai recettori di membrana, come i recettori Tyr kinases (RTKs), i recettori accoppiati a proteine G (GPCRs), i canali ionici e altri. Questi recettori trasmettono il segnale reclutando proteine adattatrici (per esempio, Grb2) e fattori di scambio (per esempio, SOS) che, a loro volta, inducono l’attivazione di Ras sulle membrane plasmatiche o sulle membrane di altri organelli. Il Ras attivato, legato al GTP, trasmette quindi il segnale attivando le protein chinasi Raf-1, B-Raf e A-Raf (Rafs) all’interno del livello MAP3K di questa cascata. Questa attivazione avviene reclutando Rafs alle membrane, dove vengono poi fosforilate e attivate. MOS è un’altra MAP3K della cascata ERK, ma opera principalmente nel sistema riproduttivo con una modalità di regolazione distinta. Dal livello MAP3K, il segnale viene poi trasmesso lungo la cascata attraverso i componenti MAPKK: MEK1/2. Essi sono attivati attraverso la fosforilazione della serina al motivo Ser-Xaa-Ala-Xaa-Ser/Thr tipico delle MAPKK nel loro ciclo di attivazione. A sua volta, le MEK1/2 attivano i loro unici substrati conosciuti, le ERK1/2 native, che funzionano come loro unici bersagli a valle, suggerendo che le MEK1/2 servono come componenti che determinano la specificità della cascata ERK1/2. Le MEK1/2 sono le uniche protein chinasi a doppia specificità che possono fosforilare entrambi i residui regolatori Thr e Tyr di ERK1/2. Circa 200 substrati distinti di ERK1/2 sono stati identificati fino ad oggi. Sono substrati sia nel citosol (ad esempio, PLA2 RSK), o su traslocazione, nel nucleo, compresi i fattori di trascrizione come Elk1, c-Fos, e c-Jun.
– MAP3K-Raf 1
Raf-1 è il più studiato delle molecole di segnalazione dei fattori di crescita a livello MAP3K della cascata. È una proteina serina/treonina chinasi di 70-75 kDa, che contiene un dominio chinasico nella metà COOH-terminale della molecola e un dominio regolatore che occupa il resto. Su stimolazione con vari mitogeni, Raf-1 subisce un’attivazione transitoria entro 2-3 mm. Il meccanismo di attivazione di Raf-1 è stato ampiamente studiato negli ultimi anni. Ora è chiaro che Raf-1 si trova a valle di HAS, che sembra interagire direttamente con la porzione terminale NH2 di Raf-1 su stimolazione.
– MAPKK-MEK1/2
Le MEK costituiscono una famiglia evolutivamente conservata di proteine serina/treonina chinasi che ad oggi comprende tre isoforme altamente omologhe (85%) nei mammiferi. Il meccanismo di attivazione di MEK-1 coinvolge la fosforilazione della proteina solo su residui di serina e sembra essere simile se fosforilato da MEKK, Raf-1, o da autofosforilazione, come determinato da mappe fosfopeptide. Le MAPKK (MEK) sono altamente specifiche per i componenti a valle ERK-1 e ERK-2. Inoltre, MAPKK non è riuscita a riconoscere né la forma denaturata del suo substrato né i peptidi contenenti i siti di fosforilazione in ERK, indicando che l’enzima richiede la forma nativa di MAPK.
– MAPK-ERK-1/2
A causa del loro alto grado di somiglianza, ERK-1 e ERK-2 sono solitamente considerati funzionalmente ridondanti. Il principale meccanismo a monte che porta alla fosforilazione di ERK-1 e -2 su entrambi questi residui regolatori è la loro fosforilazione da parte di MEK. A causa della natura piuttosto ampia del suo riconoscimento del substrato, le ERK possono fosforilare un gran numero di proteine dopo la loro attivazione. Queste proteine sono spesso di natura regolatoria e si trovano sia nel citoplasma che nel nucleo.
3. Segnalazione a valle della via Erk
– Proliferazione cellulare
L’ERK1/2 attivata fosforila RSK e sia RSK che ERK si spostano nel nucleo dove attivano molteplici fattori di trascrizione come CREB, Fos e Elk-1, provocando infine la sintesi di proteine effettrici e causando cambiamenti nella proliferazione e sopravvivenza cellulare. CREB (cAMP response element-binding protein) è un fattore di trascrizione cellulare che può potenziare la trascrizione genica per più di 10 volte. c-fos è una proteina di 380 aminoacidi con una regione leucina zipper di base per la dimerizzazione e il legame al DNA e un dominio di transattivazione al C-termine. È coinvolta in importanti eventi cellulari, tra cui la proliferazione cellulare, la differenziazione e la sopravvivenza; la proteina contenente il dominio ETS (Elk-1) è una proteina che negli esseri umani è codificata dal gene ELK1. Le funzioni di Elk-1 sono anche quelle di attivatore della trascrizione.
– Oncogenesi
L’attivazione di ERK1/2 promuove la metaplasia e lo sviluppo del tumore fosforilando Bim e Bid e causando la degradazione proteasoma di Bim e il sequestro di Bad alle proteine leganti la fosfoserina e, quindi, inibendo l’apoptosi. In un percorso separato, l’attivazione di ERK1/2 fosforila FOXO3a a Ser 294, Ser 344 e Ser 425 e facilita l’interazione FOXO3a-MDM2. Questa interazione aumenta la degradazione di FOXO3a attraverso una via ubiquitina-proteasoma dipendente da MDM2, portando allo sviluppo del tumore.
– Sviluppo e differenziazione
La segnalazione da parte di recettori tirosin-chinasi che attivano la via Ras/Raf/MAP kinase regola lo sviluppo e la differenziazione di molti tipi di cellule. Principalmente attraverso l’attivazione dei trasduttori di segnale e degli attivatori delle proteine di trascrizione (STATs).
– Ciclo cellulare
Cdc25 attiva le chinasi dipendenti dalla ciclina rimuovendo il fosfato dai residui nel sito attivo della Cdk. È nota per controllare le transizioni dalla fase G1 alla fase S e dalla fase G2 alla fase M. Erk1/2 può attivare la proteina Cdc25 e a sua volta promuovere la progressione del ciclo cellulare.
4. Regolazione della segnalazione Erk
La regolazione della segnalazione Erk è molto importante per noi per mantenere la normale funzione delle cellule. Ci sono molteplici strategie di regolazione per la cellula per regolare la via di segnalazione di Erk, principalmente includono la regolazione tramite cicli di feedback, tramite scaffold up e down stream, tramite fosfatasi e inibitori della via di segnalazione di Erk.
– Regolazione dei cicli di feedback
Ci sono diversi punti di feedback negativo nella via di ERK (Figura 1). MEK è un bersaglio e può essere inibito dalla fosforilazione ERK di MEK1/2 a Thr292 e Thr212. La fosforilazione impedisce un ulteriore aumento dell’attività di MEK da parte di PAK1 e quindi riduce l’attivazione di ERK. La fosforilazione di Raf in più siti da parte di ERK fornisce un secondo possibile meccanismo di feedback loop. L’iperfosforilazione di questi siti impedisce l’interazione di Raf con la GTPasi Ras e promuove la sua defosforilazione da parte della fosfatasi PP2A. L’attivazione o l’upregolazione trascrizionale delle fosfatasi da parte di ERK è un meccanismo alternativo di feedback negativo. Questi vari cicli di feedback negativo attivati da ERK forniscono un mezzo per limitare la durata del segnale e per riportare il percorso allo stato basale.
– Regolazione degli scaffold up e down stream
Le proteine scaffold legano due o più componenti di un percorso di segnalazione per portarli in prossimità e quindi facilitare la loro interazione funzionale. Inoltre, gli scaffold possono indirizzare questi moduli di segnalazione multi-enzima in diverse posizioni cellulari e quindi migliorare la fosforilazione di un sottoinsieme specifico di substrati down-stream. Gli scaffold influenzano anche la durata del segnale, prevengono il crosstalk tra vie simili e possono collegare l’attivazione del modulo di segnalazione a uno specifico segnale di attivazione a monte.
– Fosfatasi e inibitori
L’attività delle vie MAPK è determinata dalle azioni concorrenti delle chinasi a monte e delle fosfatasi inibitrici. Le vie MAPK sono terminate dalla defosforilazione dei loro componenti da diverse fosfatasi. Diverse fosfatasi serina/treonina, come PP2A e PP2Ca, e fosfatasi tirosina, come PTP-SL e HePTP, hanno dimostrato di inattivare le MAPK.
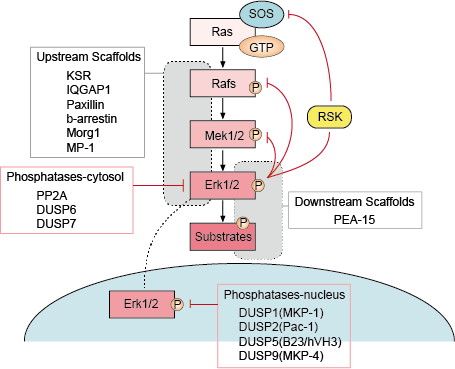
Figura 1. Regolazione della via di segnalazione di Erk
5. Relazione con le malattie
Conseguentemente ai loro ruoli critici in attività cellulari chiave, tra cui la proliferazione cellulare, la differenziazione e la sopravvivenza o la morte, le vie di segnalazione MAPK sono state implicate nella patogenesi di molte malattie umane.
– Malattia di Alzheimer
La malattia di Alzheimer (AD) è una malattia neurodegenerativa caratterizzata da disfunzioni cognitive e di memoria che si pensa derivino dalla formazione nel cervello sia di placche senili contenenti amiloide-β (Aβ) sia di grovigli neurofibrillari contenenti la proteina tau associata al microtubulo. L’evidenza suggerisce quindi che le vie di segnalazione MAPK possono contribuire alla patogenesi del MA attraverso la regolazione dell’apoptosi neuronale, l’attività β- e γ-secretasi, e la fosforilazione di APP e tau.
– Malattia di Parkinson
La malattia di Parkinson (PD) è la seconda malattia neurodegenerativa più diffusa. Varie osservazioni suggeriscono che le vie di segnalazione MAPK contribuiscono alle risposte neuroinfiammatorie e alla morte neuronale innescate dagli aggregati di α-sinucleina o da carenze funzionali di parkina o DJ-1 nella patogenesi della malattia di Parkinson.
– Segnalazione MAPK nel cancro
Molte delle mutazioni associate al cancro dei componenti delle vie di segnalazione MAPK sono state trovate in Ras e B-Raf, che partecipano entrambe alla via di segnalazione ERK. La via di segnalazione ERK gioca un ruolo in diverse fasi dello sviluppo del tumore. La fosforilazione da parte di ERK di proteine come la chinasi della catena leggera della miosina, la calpina, la chinasi di adesione focale e la paxillina promuove la migrazione delle cellule tumorali. Inoltre, la segnalazione ERK1/2 regola le attività e i livelli delle proteine della famiglia Bcl-2 come la proteina pro-apoptotica BIM e la proteina anti-apoptotica MCL-1, promuovendo così la sopravvivenza delle cellule tumorali.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |