US Pharm. 2016;41(12):HS16-HS19.
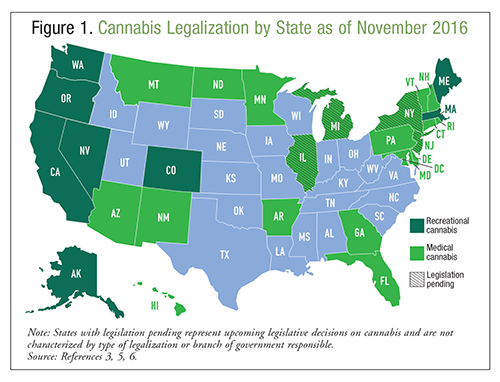
ABSTRACT: La marijuana, o cannabis, è comunemente ritenuta una sostanza benigna senza effetti avversi; tuttavia, la sindrome da iperemesi da cannabinoidi (CHS) è una conseguenza dell’uso cronico di cannabis. I medici dovrebbero sospettare fortemente la CHS nei consumatori a lungo termine di cannabis che presentano nausea e vomito intrattabili e i cui sintomi sono alleviati da un bagno in acqua calda. Una mancanza di risposta agli antiemetici dovrebbe aiutare nella diagnosi di CHS. L’unico trattamento per risolvere con successo la CHS è l’astinenza dalla cannabis, anche se l’aloperidolo è allo studio come potenziale opzione di trattamento. La marijuana, o cannabis, è un prodotto naturale derivato da una pianta di canapa nota come Cannabis sativa; è comunemente considerata una sostanza benigna senza effetti avversi.1 La cannabis può essere fumata, vaporizzata o ingerita per intossicazione o beneficio terapeutico, ed è stata usata per secoli per questi scopi. Secondo il 2014 National Survey on Drug Use and Health, >22 milioni di americani hanno fatto uso di cannabis nel mese precedente, rendendo questa sostanza la droga illecita più comunemente usata.2 Si prevede che il consumo di cannabis negli Stati Uniti continuerà a crescere a causa dei crescenti tassi di legalizzazione.3 Secondo il National Epidemiologic Survey on Alcohol and Related Conditions, i residenti degli stati che hanno legalizzato la cannabis medica hanno il doppio delle probabilità di approvare l’uso della cannabis rispetto ai residenti degli stati senza legalizzazione.4 Attualmente, la cannabis può essere usata per scopi medici in 28 stati, e può anche essere usata a scopo ricreativo in otto di essi. Riferirsi alla FIGURA 1 per informazioni sulla legalità della cannabis in tutti gli USA al momento della stesura del presente documento.3,5,6 Oltre alla legalizzazione, 21 stati e il distretto di Columbia hanno depenalizzato il possesso di piccole quantità di cannabis. Le emergenze mediche legate al consumo di cannabis sono aumentate del 29% dal 2009 al 2011; non è noto se questo aumento sia dovuto alla potenza della cannabis, all’aumento della legalizzazione o ad altri fattori.1
Il corpo umano ha un sistema cannabinoide intrinseco, noto come sistema endocannabinoide, che contiene neurotrasmettitori (cioè l’anandamide) che regolano l’appetito, il sonno, il dolore, le emozioni e il movimento.7,8 Cannabinoide si riferisce a qualsiasi composto che influenza i recettori cannabinoidi nel corpo. I recettori che servono a scopi terapeutici includono i cannabinoidi di tipo 1 e 2 (CB1, CB2). Il CB1 si trova in grandi quantità nel cervello e in quantità minori nei tessuti nervosi spinali e periferici, mentre il CB2 si trova in grandi quantità nei tessuti periferici e nel sistema immunitario.8
La cannabis contiene >100 sostanze chimiche, di cui il delta-9-tetraidrocannabinolo (THC) è il composto più attivo. Poiché si lega al CB1, il THC è responsabile dell’effetto intossicante della cannabis.1 Altri cannabinoidi presenti nella cannabis includono il cannabidiolo e il cannabigerolo, che non sono psicoattivi. A causa della vasta gamma di attività che il sistema intrinseco influenza, molte persone hanno usato i cannabinoidi per l’intossicazione e per scopi terapeutici.
Sindrome da iperemesi cannabinoide
La cannabis è stata usata per promuovere l’appetito nel trattamento dell’anoressia e del deperimento associati all’HIV/AIDS e per alleviare nausea e vomito indotti dalla chemioterapia. Anche se la cannabis può essere usata per trattare nausea e vomito, può anche causare una sindrome paradossale di nausea e vomito nota come sindrome da iperemesi da cannabinoidi (CHS). La CHS è una diagnosi clinica caratterizzata dall’uso cronico di cannabis.9 Una caratteristica unica della CHS è la nausea e il vomito ciclici che possono non rispondere alla terapia antiemetica standard ma rispondere al bagno caldo compulsivo.3,9 Il primo case report che documenta la CHS (2004) ha descritto nove pazienti in Australia. L’uso cronico di cannabis si era verificato prima della presentazione, e i sintomi includevano nausea e vomito. La maggior parte dei pazienti ha riferito di fare il bagno in acqua calda per alleviare i sintomi. La cessazione dell’uso di cannabis ha portato alla risoluzione della malattia, mentre i pazienti che hanno continuato a usare cannabis sono rimasti malati.10 Da allora, sono stati pubblicati altri case report e serie che descrivono ulteriormente la CHS; tuttavia, nessuno studio randomizzato e controllato l’ha valutata o definita.
In Colorado, i tassi di CHS sono raddoppiati dal 2009, quando la cannabis è stata legalizzata.3 Tuttavia, è importante notare che la CHS spesso non viene riconosciuta dai medici, il che può portare a un esteso e costoso controllo del paziente. La diagnosi può essere difficile, e la CHS può essere erroneamente diagnosticata come molti altri disturbi, compresa la sindrome del vomito ciclico (CVS). Anche se alcuni pazienti che usano marijuana presentano la CVS, ci sono diversi fattori che differenziano la CVS dalla CHS. La CVS di solito comporta una storia personale o familiare di emicranie, una storia di disturbi psichiatrici, e una mancanza di bagni caldi compulsivi.11 I pazienti con CHS spesso si presentano al dipartimento di emergenza (ED) a causa dei sintomi. Un case report di Soriano-Co e colleghi ha dimostrato che i pazienti con diagnosi di CHS avevano maggiori probabilità di avere frequenti visite mediche, visite al pronto soccorso e ospedalizzazioni.12 In media, un paziente ha avuto cinque visite mediche, sette visite al pronto soccorso e tre ospedalizzazioni prima che si verificasse la diagnosi, indicando che i pazienti con CHS potrebbero essere visti in qualsiasi ambiente di cura.12 A complicare ulteriormente la diagnosi è l’uso di cannabinoidi sintetici, come il K2, alias Spice, che non può essere rilevato dagli screening delle urine.13 La CHS deve essere differenziata da altri disturbi che causano nausea e vomito, e la diagnosi è generalmente di esclusione.
Patofisiologia
Ci sono molteplici ipotesi riguardanti la fisiopatologia della CHS; tuttavia, a causa della moltitudine di sostanze chimiche attive nella cannabis e l’esistenza di vari siti di azione, il processo fisiopatologico definitivo è sconosciuto. Inoltre, non tutti i consumatori di cannabis sviluppano la CHS, causando ulteriori difficoltà nel descrivere la sindrome.
A basse dosi, il THC è noto per esercitare un effetto antiemetico, ma con un uso pesante e cronico di cannabis, si osserva il contrario. È stato suggerito che il THC si accumula nel tempo a causa del suo grande volume di distribuzione. Il THC può attivare direttamente i recettori CB1 nel sistema nervoso enterico e ridurre la motilità gastrica, aumentando il rischio di nausea e vomito con un’attivazione eccessiva.9 I cannabinoidi sintetici, che imitano sia l’effetto che la struttura del THC, sono ipotizzati per causare un’iperstimolazione del recettore CB1 a causa dei loro potenti effetti agonisti.14 Questi recettori CB1 si trovano anche nell’ipotalamo e possono indurre emesi compromettendo la termoregolazione, portando al potenziale sollievo dei sintomi attraverso bagni caldi.9,11
Fattori di rischio, decorso clinico e diagnosi
L’uso cronico di cannabis è il principale fattore di rischio per lo sviluppo della CHS. Il rischio per un paziente di CHS aumenta con l’uso prolungato di cannabis.9 L’uso quotidiano di cannabis sembra avere più probabilità di causare CHS rispetto all’uso meno frequente; tuttavia, qualsiasi quantità di cannabis può portare a CHS.15
La CHS ha diverse fasi, che sono state classificate come preemetica, iperemetica e di recupero.9,16 La fase preemetica, che può durare da mesi ad anni, è caratterizzata da nausea, paura di vomitare e malessere addominale. Comunemente, i consumatori di cannabis aumentano l’assunzione di cannabis durante la fase preemetica nel tentativo di alleviare la nausea.11 Durante la fase iperemetica, che in genere dura da 24 a 48 ore, il paziente sperimenta frequenti nausee e vomito di natura grave. Questo può portare a perdita di peso e disidratazione acuta, potenzialmente con conseguente insufficienza prerenale.17,18 La nausea e il vomito persistenti possono causare lo sviluppo di anomalie elettrolitiche.
Per alleviare i sintomi, i pazienti possono iniziare a fare bagni caldi, cioè rimanere in un bagno o una doccia caldi per ore.11 Questo è un comportamento auto-imparato che diventa compulsivo una volta che il paziente si rende conto del beneficio. Il bagno caldo può aiutare la termoregolazione e la riduzione del flusso di sangue allo stomaco, influenzando la vasodilatazione periferica e la ridistribuzione dalla circolazione splancnica, con conseguente diminuzione del vomito.11 Purtroppo, il bagno caldo può aumentare il rischio di disidratazione e di insufficienza renale acuta.17 Il bagno caldo dovrebbe essere considerato una caratteristica patognomonica, in quanto non si osserva in altre condizioni che possono avere una presentazione altrimenti simile. I pazienti tipicamente interrompono il bagno caldo quando i sintomi non sono presenti e lo ricominciano quando nausea e vomito si ripresentano dopo l’uso futuro di cannabis.
Molti pazienti cercano cure mediche per i loro sintomi durante la fase iperemetica. Di conseguenza, i pazienti possono sottoporsi ad estesi esami negativi per varie altre condizioni, come la CVS, la pancreatite e la gastroparesi, che possono simulare alcuni sintomi della CHS. Una volta che la nausea e il vomito si placano, di solito entro 48 ore, il paziente entra nella fase di recupero. Il recupero può variare da giorni a mesi ed è associato alla cessazione del consumo di cannabis. Se il paziente ricomincia con la cannabis, i sintomi di solito ritornano.11
E’ importante considerare l’impatto della CHS sugli altri stati patologici del paziente. Ci sono casi di pazienti con CHS che hanno sviluppato problemi medici legati alla CHS diversi dall’insufficienza renale. Gregoire e colleghi hanno descritto un paziente con una storia di mania bipolare e uso di cannabis che ha sviluppato la CHS.19 Il paziente ha attribuito il vomito intrattabile al litio e ha smesso di prendere il litio, e si è verificato un episodio maniacale. La reinizializzazione del litio in ospedale non ha provocato ulteriore vomito, indicando che la cannabis era la probabile causa.19
Sono stati proposti criteri diagnostici per la CHS. L’uso prolungato di cannabis è essenziale per la diagnosi. Il tempo necessario per sviluppare la CHS varia; tuttavia, la maggior parte dei pazienti si presenta da 1 a 5 anni dopo l’uso cronico di cannabis. La presentazione di sintomi simili a quelli della CHS prima di 1 anno di uso cronico di cannabis non dovrebbe precludere la diagnosi. Le caratteristiche principali della CHS includono nausea e vomito ciclici gravi, risoluzione dei sintomi alla cessazione della cannabis, sollievo ottenuto con un bagno in acqua calda, dolore addominale epigastrico o periombelicale, e uso settimanale di cannabis. Le caratteristiche di supporto che portano ad una diagnosi di CHS includono l’età <50 anni, perdita di peso >5 kg, comparsa dei sintomi al mattino, abitudini intestinali normali, e risultati normali su altri esami.15 La TABELLA 1 riassume i risultati comuni che supportano una diagnosi di CHS.14

Trattamenti potenziali
Le cure di supporto sono indicate per tutti i pazienti che si presentano nella fase iperemetica della CHS. Se il paziente può tollerarlo, l’assunzione orale di liquidi è raccomandata per l’idratazione. Alcuni pazienti non possono tollerare l’idratazione orale a causa dell’eccessivo vomito, quindi i liquidi per via endovenosa possono essere indicati per la deplezione di volume associata alla disidratazione.11 Poiché con il vomito possono verificarsi disturbi elettrolitici, è indicato il monitoraggio e la sostituzione degli elettroliti.
Il bagno caldo compulsivo è un comportamento appreso caratteristico che i pazienti possono usare per minimizzare i sintomi associati alla CHS. Come è stato discusso in precedenza, il bagno caldo può aiutare la termoregolazione. Un’altra teoria è che la vasodilatazione periferica e la ridistribuzione dalla circolazione splancnica possono ridurre il flusso di sangue allo stomaco, con conseguente diminuzione del vomito.11 Un singolo caso ha indicato che l’alleviamento dei sintomi con il bagno caldo può diminuire nel tempo; tuttavia, questo fenomeno sembra essere poco comune.20
Gli antiemetici sono stati usati senza successo per alleviare i sintomi della CHS. La mancanza di risposta agli antiemetici dovrebbe indurre il medico a sospettare la CHS. In alcuni casi, i pazienti non hanno avuto alcun sollievo terapeutico da nausea e vomito con ondansetron, prometazina, clorpromazina o metoclopramide.21 In una piccola serie di casi, l’87,5% dei pazienti non ha risposto alla terapia antiemetica standard.12
L’aloperidolo esercita effetti antipsicotici antagonizzando i recettori della dopamina D2 nelle vie mesolimbiche e mesocorticali. L’aloperidolo è tradizionalmente usato per trattare l’agitazione; tuttavia, è stato usato con successo come antiemetico in chirurgia generale e in oncologia. I recettori D2 sono presenti anche nella zona di attivazione dei chemorecettori, il che potrebbe spiegare queste proprietà antiemetiche. Gli studi sugli animali suggeriscono che il CB1 può essere influenzato dall’aloperidolo, rendendo questo agente una potenziale opzione di trattamento.22,23 Witsil e Mycyk hanno valutato questa ipotesi retrospettivamente in quattro pazienti con nausea e vomito refrattari alla terapia antiemetica standard.21 Tutti i pazienti hanno trovato sollievo entro 1 o 2 ore dalla somministrazione di aloperidolo 5 mg endovena.21,24 Questa piccola casistica dimostra che l’aloperidolo può alleviare la nausea e il vomito correlati alla CHS in misura sufficiente a prevenire il ricovero in ospedale, il che può portare a un risparmio per il sistema sanitario.19 Il rischio di prolungamento del QTc con l’aloperidolo deve essere considerato, soprattutto nei pazienti con disturbi elettrolitici come risultato di un vomito eccessivo. Sono necessari ulteriori studi per determinare il posto dell’aloperidolo nella terapia e il suo dosaggio ottimale.
La sospensione della cannabis è l’unico trattamento che allevia e previene i sintomi associati alla CHS. Nello studio che ha descritto per la prima volta la CHS, l’astinenza dalla cannabis ha portato alla cessazione della nausea e del vomito in sette dei dieci pazienti, mentre gli altri hanno continuato a soffrire della malattia. Tre dei sette pazienti hanno poi ripreso a consumare cannabis, e i sintomi sono tornati nel giro di pochi mesi.10 Questi risultati sono stati replicati in recenti case report.12,25 I pazienti dovrebbero essere educati alla cessazione della cannabis come alleviatore di sintomi, e dovrebbero essere fornite risorse per aiutare a smettere.
Conclusione
Quando la cannabis è legalizzata in più stati, è probabile che il suo uso aumenterà e saranno riportati più casi di CHS. I medici dovrebbero sospettare la CHS nei pazienti che si presentano con una storia di uso di cannabis o di cannabinoidi sintetici e sintomi che includono nausea e vomito intrattabili, insieme a rapporti di uso di bagni caldi per il controllo dei sintomi. Questa congettura potrebbe prevenire esami estesi e costosi per altre condizioni. I farmacisti hanno un ruolo nel consigliare i pazienti sui rischi associati all’uso di cannabis e nel riferire i pazienti con sintomi di CHS per un’appropriata cura di follow-up. I casi riportati in letteratura hanno identificato i fattori di rischio per la CHS. Sfortunatamente, la CHS è relativamente poco diffusa, e il suo esatto meccanismo è sconosciuto. La diagnosi e il trattamento della CHS sono attualmente basati su piccoli rapporti di casi. Le informazioni dovrebbero continuare ad essere valutate man mano che diventano disponibili al fine di garantire un trattamento appropriato.
1. Istituto Nazionale sull’Abuso di Droghe (NIDA). Cos’è la marijuana? www.drugabuse.gov/publications/research-reports/marijuana/what-marijuana. Accessed August 25, 2016.
2. NIDA. Qual è la portata del consumo di marijuana negli Stati Uniti? www.drugabuse.gov/publications/research-reports/marijuana/what-scope-marijuana-use-in-united-states. Accessed August 25, 2016.
3. Kim HS, Monte AA. Colorado cannabis legalizzazione e il suo effetto sulla cura di emergenza. Ann Emerg Med. 2016;68:71-75.
4. Cerdá M, Wall M, Keyes KM, et al. Medical marijuana laws in 50 states: investigating the relationship between state legalization of medical marijuana and marijuana use, abuse and dependence. Droga Alcol Dipendenza. 2012;120:22-27.
5. CNN Money. Dove l’erba è legale. http://money.cnn.com/interactive/news/economy/marijuana-legalization-map/index.html. Accessed August 25, 2016.
6. Marijuana Policy Project. Legislazione di riforma della politica della marijuana del 2016. www.mpp.org/states/key-marijuana-policy-reform. Accessed November 13, 2016.
7. NIDA. Come la marijuana produce i suoi effetti? www.drugabuse.gov/publications/research-reports/marijuana/how-does-marijuana-produce-its-effects. Accessed August 2016.
8. Manzanares J, Julian MD, Carrascosa A. Ruolo del sistema cannabinoide nel controllo del dolore e implicazioni terapeutiche per la gestione degli episodi di dolore acuto e cronico. Curr Neuropharmacol. 2006;4:239-257.
9. Galli JA, Sawaya RA, Friedenberg FK. Sindrome da iperemesi da cannabinoidi. Curr Drug Abuse Rev. 2011;4:
241-249.
10. Allen JH, de Moore GM, Heddle R, Twartz JC. Iperemesi da cannabinoidi: iperemesi ciclica in associazione con l’abuso cronico di cannabis. Gut. 2004;53:1566-1570.
11. Ruffle JK, Bajgoric S, Samra K, et al. Sindrome da iperemesi da cannabinoidi: un’importante diagnosi differenziale del vomito persistente inspiegabile. Eur J Gastroenterol Hepatol. 2015;27:1403-1408.
12. Soriano-Co M, Batke M, Cappell MS. La sindrome di iperemesi da cannabis caratterizzata da nausea persistente e vomito, dolore addominale e bagno compulsivo associato all’uso cronico di marijuana: un rapporto di otto casi negli Stati Uniti. Dig Dis Sci. 2010;55:3113-3119.
13. Ukaigwe A, Karmacharya P, Donato A. A gut gone to pot: a case of cannabinoid hyperemesis syndrome due to K2, a synthetic cannabinoid. Case Rep Emerg Med. 2014;2014:167098.
14. Hopkins CY, Gilchrist BL. Un caso di sindrome da iperemesi da cannabinoidi causata da cannabinoidi sintetici. J Emerg Med. 2013;45:544-546.
15. Simonetto DA, Oxentenko AS, Herman ML, Szostek JH. Iperemesi da cannabinoidi: una serie di 98 pazienti. Mayo Clin Proc. 2012;87:114-119.
16. Lu ML, Agito MD. Sindrome da iperemesi da cannabinoidi: la marijuana è sia antiemetica che proemetica. Cleve Clin J Med. 2015;82:429-434.
17. Habboushe J, Sedor J. Cannabinoid hyperemesis insufficienza renale acuta: una sequela comune della sindrome da iperemesi di cannabinoidi. Am J Emerg Med. 2014;32:690.e1-e2.
18. Srihari P, Liu M, Punzell S, et al. Sindrome da iperemesi da cannabinoidi associata a doccia compulsiva e danno renale acuto. Prim Care Companion CNS Disord. 2016;18(1).
19. Gregoire P, Tau M, Robertson D. Sindrome da iperemesi da cannabinoidi e insorgenza di un episodio maniacale. BMJ Case Rep. 2016;2016.
20. Bagdure S, Smalligan RD, Sharifi H, Khandheria B. Effetto calante del bagno compulsivo nell’iperemesi da cannabinoidi. Am J Addict. 2012;21:184-185.
21. Witsil JC, Mycyk MB. Aloperidolo, un nuovo trattamento per la sindrome da iperemesi da cannabinoidi. Am J Ther. 2014 Nov 12 .
22. Schulze DR, Carroll FI, McMahon LR. Interazioni tra il trasportatore di dopamina e i ligandi del recettore dei cannabinoidi nelle scimmie rhesus. Psicofarmacologia (Berl). 2012;222:425-438.
23. Desai RI, Thakur GA, Vemuri VK, et al. Analisi della tolleranza e della dipendenza comportamentale/fisica durante il trattamento cronico con agonisti CB1: effetti di agonisti CB1, antagonisti e farmaci non cannabinoidi. J Pharmacol Exp Ther. 2013;344:319-328.
24. Hickey JL, Witsil JC, Mycyk MB. Aloperidolo per il trattamento della sindrome da iperemesi da cannabinoidi. Am J Emerg Med. 2013;31:1003.e5-e6.
25. Pélissier F, Claudet I, Gandia-Mailly P, et al. Sindrome da iperemesi da cannabis nel dipartimento di emergenza: come può essere utile un team specializzato in dipendenze? Uno studio pilota. J Emerg Med. 2016;51:544-551.