本製品を販売するFDAの承認に関する情報の概要について説明します。 本製品、その適応症、およびFDAの承認の根拠に関するより詳細な情報については、以下の安全性および有効性データの概要(SSED)および製品の添付文書へのリンクをご覧ください。 Inspire® Upper Airway Stimulation (UAS)
PMA申請者。 Inspire Medical Systems, Inc.
住所。 5500 Wayzata Blvd. Suite 1600
Golden Valley, MN 55416 US
Approval Date: 2020年4月14日
承認レター。 Approval Order
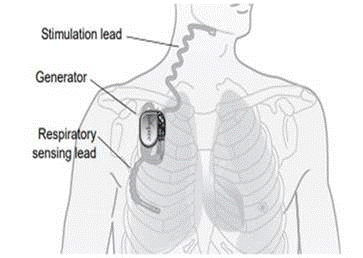
どのような製品ですか? Inspire®上気道刺激(UAS)システムは、中等度から重度の閉塞性睡眠時無呼吸症候群(OSA)の治療に使用される植込み型神経刺激装置である。 Inspire® UASシステムは、植込み型パルスジェネレータ(IPG)、刺激用リード、感知用リードなどの植込み型コンポーネントと、医師用プログラマ、患者用プログラマなどの外部コンポーネントで構成されています。
今回の承認により、Inspire® UASの適応症は、中等度から重度のOSAを有する18歳から21歳までの患者さんに拡大されます。
- 上気道が完全に閉塞していない
- 扁桃および鼻の後ろのその他の軟組織を除去できない、または効果的に治療できない
- PAP療法に失敗することが確認されているか、コンプライアンスを改善しようとしても耐えられない
- 他のすべての代替/補助療法について標準治療に従っている
仕組みはどのようになっていますか? 植え込み型パルスジェネレータは、患者の呼吸パターンを検出し、軽度の神経刺激により気道を開いた状態に維持します。 医師は、外部の医師用プログラマを使用して刺激設定を構成することができます。
どのような時に使用するのですか? Inspire® UAS システムは、中程度から重度の OSA 患者のサブセットの治療に使用されます。 無呼吸(息切れ)または低呼吸(息切れの一部)の重症度は、無呼吸-低呼吸指数(AHI)と呼ばれる尺度によって判断されます。 中等度から重度のOSAは、AHIが15以上、65以下とされています。 Inspire® UASは、気道陽圧(PAP)治療(持続気道陽圧装置や二段階気道陽圧装置など)が無効または耐えられないことが確認された18歳以上の成人患者で、上気道が完全に閉塞していない場合に使用されます。
PAP失敗はOSAを解消できないこと(PAP使用にもかかわらずAHIが15以上)、PAP不耐性は次のように定義されます:
- PAPを使用できないこと(週5日以上使用、使用は1晩4時間以上と定義)、または
- PAP使用不本意(例えば、使用しようとした後にPAPシステムを返却する場合)。
何を達成するのでしょうか。 Inspire® UASの最初の承認をサポートするために、22の治験施設にわたって126人の患者が臨床試験に参加しました。 Inspire® UAS療法は、大多数の患者さんに閉塞性睡眠時無呼吸症候群の重症度の臨床的に意味のある低下とQOLの改善をもたらしました。 全患者の半数以上がInspire® UAS療法の反応者とみなされ、AHIが50%以上減少し、12ヶ月後のエンドポイントにおけるAHIが20イベント/時間未満となった。 また、Inspire® UAS治療反応者は、睡眠時無呼吸症候群の重症度を示す尺度である酸素飽和度指数(ODI)が25%以上減少しました。 ダウン症の小児患者を対象とした小規模な臨床試験に加え、この試験の結果は、適応症を18歳から21歳の年長の青年に拡大するための裏付けとなりました」
使用すべきでない場合は? Inspire® UASシステムは、以下のような用途に使用しないでください。
- 閉塞性以外の無呼吸(中枢性および混合性)のタイプが、総AHIの25%以上
- 上気道刺激の性能を損なうようなあらゆる物理的所見。 上気道の完全な閉塞の存在など
- 上気道の神経学的制御を損なうあらゆる状態または処置
- 睡眠リモートの操作に必要な支援ができない、またはない患者
- 妊娠中または妊娠予定の患者
- Inspire®システムと予期せぬ相互作用を引き起こす可能性がある埋め込み式のデバイスを持つ患者
- MR条件付き表示で指定されているもの以外に磁気共鳴画像法(MRI)を必要とする患者
。 相互作用の可能性を評価するために、機器メーカーに相談すること。
追加情報(警告、注意、有害事象など):
- 安全性および有効性に関するデータの概要(SSED)
- 医師の表示
- 患者の表示
- PMA データベースへの入力
追加情報(警告、使用制限、有害事象など):
ul