Knut Eichhorn-Mulligan, MD, PhD und Ivana K. Kim, MD, Boston
Choroidale Nävi, insbesondere kleine, sind häufig. Ihre Prävalenz wird auf 5 bis 10 Prozent der Allgemeinbevölkerung geschätzt. In der Blue Mountains Eye Study wurden Aderhautnävi bei 6,5 Prozent einer prospektiv untersuchten Population von überwiegend weißen Australiern mittleren Alters festgestellt.1 Aderhautmelanome hingegen sind glücklicherweise selten, ihre Inzidenz wird auf etwa sechs pro Million geschätzt. Dennoch ist das Aderhautmelanom das häufigste primäre intraokulare Malignom bei Erwachsenen, und eine schnelle und genaue Diagnose ist wichtig.
Charakteristika von Nävi
Histologisch gesehen sind Nävi gutartige Neubildungen der Melanozyten, die sich in den äußeren Schichten der Aderhaut befinden. Sie erscheinen typischerweise als flache, schiefergraue Läsion unter der Netzhaut. In bis zu 10 Prozent der Fälle können Nävi jedoch völlig unpigmentiert sein.2 Das Risiko einer bösartigen Transformation wird als recht gering eingeschätzt.3 Dennoch können Nävi zu Sehstörungen führen, insbesondere wenn sie sich in der Nähe der Fovea befinden. Durch Kompression der darüber liegenden Choriocapillaris können dickere Nävi den Blutfluss zum RPE und den äußeren Netzhautschichten behindern und zu einer Degeneration des RPE und der Photorezeptoren führen.4 Nävi wurden bei überraschend vielen Patienten mit Gesichtsfelddefekten in Verbindung gebracht, obwohl diese Defizite, wenn sie peripher sind, möglicherweise nicht symptomatisch werden.5,6 Zu den visuell bedeutsameren Komplikationen, die im Zusammenhang mit gutartigen Nävi beobachtet wurden, gehören seröse Ablösungen des RPE und der Netzhaut sowie choroidale Neovaskularisation.4 Eine kürzlich durchgeführte Überprüfung der Sehfunktion bei mehr als 3.400 Patienten mit Nävi am Wills Eye Hospital ergab, dass das geschätzte Risiko für einen Sehkraftverlust über 15 Jahre bei Patienten mit extrafovealen Nävi 2 Prozent, bei Patienten mit subfoveolaren Nävi jedoch 26 Prozent betrug.7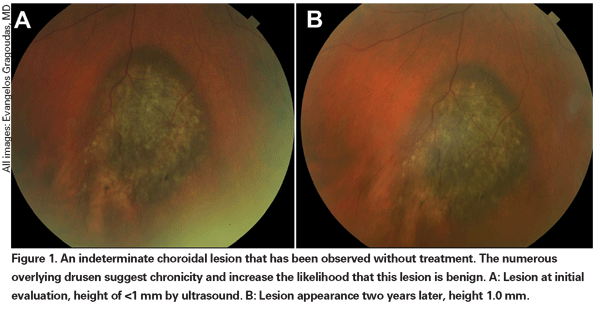
Ob Melanome aus bereits bestehenden Nävi entstehen oder tatsächlich eine eigenständige Entität sind, ist umstritten. Bei der Analyse von enukleierten Augen wurden histologische Merkmale nachgewiesen, die für Nävi an den Rändern maligner Melanome charakteristisch sind, was darauf hindeutet, dass zumindest einige Melanome aus einer malignen Transformation innerhalb bereits bestehender Nävi entstehen können.8 Dennoch wird das Risiko, dass sich ein Aderhautnävus in ein Melanom verwandelt, im Allgemeinen als äußerst gering angesehen. Die Schätzungen der jährlichen Raten der malignen Transformation schwanken zwischen einem von 4.800 und einem von 8.800.3,9
Im Allgemeinen vergrößern sich kleine Aderhautnävi selten. In der Blue-Mountains-Studie wies von 160 Nävi (mittlerer Durchmesser 1,25 mm), für die eine Nachbeobachtungszeit von mindestens fünf Jahren zur Verfügung stand, nur ein einziges eine leichte Vergrößerung des Durchmessers auf.10 Es gibt jedoch mehrere Berichte über histologisch bestätigte choroidale Nävi, die eine fortschreitende Vergrößerung aufwiesen, aber bei sorgfältiger Überprüfung keine bösartigen Merkmale zeigten.11,12 Darüber hinaus stellten Carol Shields, MD, und Kollegen in einer Analyse von mehr als 2.500 Augen, die in einer tertiären Überweisungspraxis beobachtet wurden, eine Vergrößerung bei 3 bis 4 Prozent der Nävi ohne Merkmale einer malignen Transformation fest.2 Die Nävi in dieser klinikbasierten Kohorte waren zu Beginn signifikant größer als die in der bevölkerungsbasierten Blue Mountains-Studie, mit einem durchschnittlichen Durchmesser von etwa 5 mm.

Erkennung kleiner Melanome
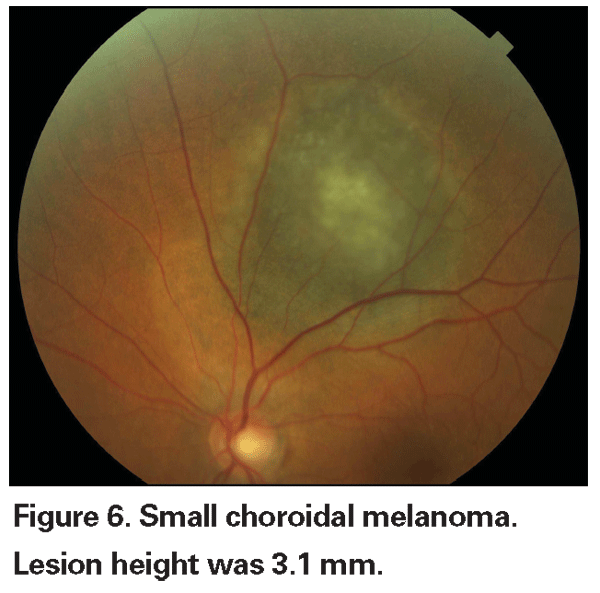
Pigmentierte Aderhautläsionen, die leicht erhöht sind, können als unbestimmte Läsionen bezeichnet werden und stellen eine Herausforderung in Bezug auf Diagnose und Behandlung dar. Angesichts der Risiken und Einschränkungen bei der histologischen Bestätigung der Bösartigkeit müssen sich Augenärzte auf klinische Merkmale stützen, die als Vorhersage für Wachstum und Metastasierung gelten, um kleine Melanome von erhöhten melanozytären Aderhauttumoren zu unterscheiden, die wahrscheinlich gutartig sind. Dr. Shields und Kollegen identifizierten fünf Faktoren, die mit dem Risiko des Wachstums kleiner melanozytärer Aderhautläsionen mit einer Dicke von weniger als 3 mm assoziiert sind, anhand retrospektiver Analysen von etwa 1 300 Patienten.13 Diese Faktoren waren: 1) Tumordicke größer als 2,0 mm; 2) subretinale Flüssigkeit; 3) visuelle Symptome; 4) orangefarbenes Pigment; 5) hinterer Tumorrand, der die Papille berührt. Läsionswachstum wurde bei 4 Prozent der Patienten ohne einen dieser Risikofaktoren, bei 36 Prozent der Patienten mit einem Risikofaktor und bei mehr als 50 Prozent der Patienten mit drei oder mehr Faktoren beobachtet.14 Zu den klinischen Faktoren, die mit einem erhöhten Metastasierungsrisiko verbunden sind, gehören: 1) ein hinterer Rand, der die Papille berührt, 2) dokumentiertes Wachstum und 3) eine größere Tumordicke (größer/gleich 1,1 mm).13 In der von der Collaborative Ocular Melanoma Study (COMS)-Gruppe durchgeführten Beobachtungsstudie zu kleinen Tumoren wurden ähnliche Risikofaktoren identifiziert, die mit dem Tumorwachstum assoziiert sind, nämlich 1) eine größere apikale Tumordicke, 2) ein größerer anfänglicher basaler Durchmesser, 3) das Vorhandensein von orangefarbenem Pigment, 4) das Fehlen von Drusen und 5) das Fehlen von Veränderungen des retinalen Pigmentepithels neben dem Tumor.15 Die beiden letztgenannten Faktoren bestätigen die klinische Beobachtung, dass das Vorhandensein von Drusen und Pigmentveränderungen Indikatoren für eine Chronifizierung sind und daher eher als ruhende, gutartige Läsionen zu sehen sind. 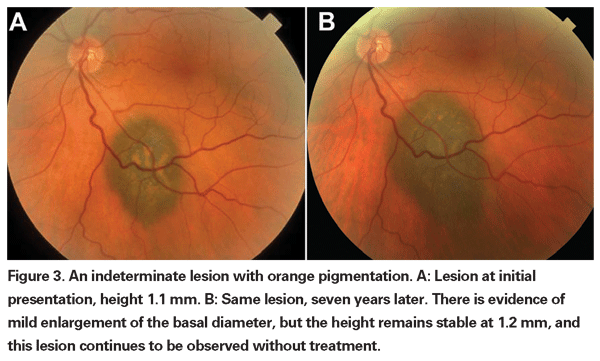
Auch bildgebende Merkmale können bei der Beurteilung des Malignitätspotenzials hilfreich sein. Das Vorhandensein einer inneren Ruhezone auf dem B-Scan-Ultraschall und von Hot Spots auf der Fluoreszeinangiographie haben sich als Prädiktoren für das Tumorwachstum erwiesen.16 Die Rolle der optischen Kohärenztomographie bei der Beurteilung von Aderhautläsionen wird ebenfalls erforscht. Dr. Gabriella Espinoza und Kollegen haben vorgeschlagen, dass die OCT bei der Unterscheidung zwischen aktiver subretinaler Flüssigkeit, bei der die über der Läsion liegende Netzhaut erhöht ist, aber ansonsten normal aussieht, und chronischen Veränderungen wie Netzhautverdünnung oder intraretinalen Zysten hilfreich sein kann. In ihrer kleinen Serie fanden sie eine Korrelation zwischen aktiver subretinaler Flüssigkeit im OCT und dokumentiertem Tumorwachstum.17
Frühe Behandlung vs. Beobachtung
Als die Enukleation die einzige akzeptierte Behandlungsform für Melanome war, wurde bei kleinen Tumoren, die bei der Erstvorstellung nicht eindeutig als Melanome diagnostiziert werden konnten, die Beobachtung bis zum dokumentierten Wachstum befürwortet. Mit der Verfügbarkeit und nachgewiesenen Wirksamkeit von Therapien, die den Augapfel schonen, kann nun für eine frühere Behandlung dieser unbestimmten Läsionen argumentiert werden. Daten aus den COMS-Studien zeigen, dass die melanombedingte Sterblichkeit mit der Tumorgröße zum Zeitpunkt der Behandlung variiert. Bei mittelgroßen Tumoren (definiert als Tumoren mit einer apikalen Höhe von 2,5 bis 10 mm und einem größten basalen Durchmesser von bis zu 16 mm) betrug die melanomspezifische Sterblichkeit nach fünf Jahren 10 Prozent und nach 10 Jahren 18 Prozent.18 Bei großen Tumoren (d. h. Tumoren, die die Größenkriterien für mittelgroße Tumoren entweder hinsichtlich der apikalen Höhe oder des größten basalen Durchmessers überschreiten, oder peripapilläre Tumoren mit einer apikalen Höhe von mehr als 8 mm) stiegen die Raten nach fünf Jahren auf etwa 27 Prozent und nach zehn Jahren auf 40 Prozent.19 Wie bereits erwähnt, hat sich außerdem gezeigt, dass ein dokumentiertes Wachstum vor der Behandlung ein Risikofaktor für die Metastasierung darstellt. Das Wachstum kann jedoch ein Marker für aggressivere Tumore sein, und es ist nicht erwiesen, dass eine frühere Behandlung dieser Tumore die Sterblichkeit verringert.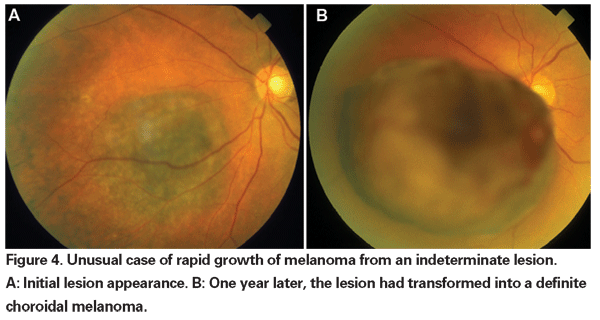
Unsere derzeitigen Methoden der Strahlentherapie ermöglichen eine wirksame lokale Tumorkontrolle mit Erhaltung des Augapfels, aber die visuelle Morbidität ist immer noch hoch. Daher ist es notwendig, das Mortalitätsrisiko, das durch eine sorgfältige Beobachtung vor der Behandlung unbestimmter Läsionen entsteht, gegen die Folgen des durch die Therapie verursachten Sehverlusts abzuwägen. In der COMS-Beobachtungsstudie zu kleinen Tumoren gab es sechs melanombedingte Todesfälle in einer Gruppe von 67 Patienten mit Tumoren, die nach einer anfänglichen Beobachtungsphase behandelt wurden.20 Nur zwei dieser Todesfälle ereigneten sich innerhalb von fünf Jahren nach Aufnahme in die Studie, was zu einer ungefähren melanomspezifischen Fünf-Jahres-Mortalitätsrate von 3 Prozent führte. Kürzlich berichteten Forscher des Bascom Palmer Eye Institute über eine fünfjährige melanomspezifische Sterblichkeitsrate von 3,9 Prozent bei einer kleinen Gruppe von Patienten mit Verdacht auf Aderhautmelanom, bei denen vor der Behandlung mit Plaque-Strahlentherapie das Wachstum oder die Entwicklung von orangefarbenem Pigment beobachtet wurde.21 Diese Studien deuten auf niedrige Sterblichkeitsraten im Zusammenhang mit einer verzögerten Behandlung von unbestimmten Läsionen hin. Darüber hinaus zeigte eine kleine retrospektive Serie keinen Anstieg der melanomspezifischen Sterblichkeit zwischen sofort behandelten und zunächst beobachteten Patienten.22 Bisher gibt es keine Belege für einen Überlebensvorteil durch eine frühere gegenüber einer verzögerten Behandlung von kleinen Tumoren, die nicht eindeutig als Melanom diagnostiziert werden können. Daher ist nicht klar, ob der Verzicht auf das Sehvermögen bei einer größeren Zahl von Patienten mit unbestimmten Läsionen definitiv mehr Leben rettet.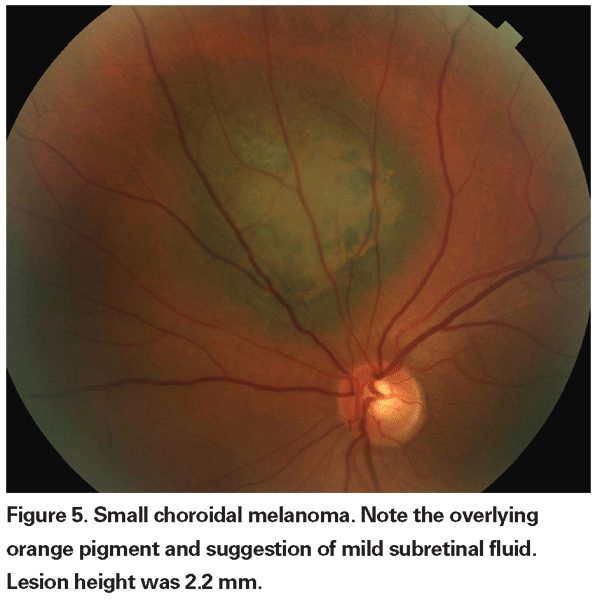
Zusammenfassend kann man choroidale pigmentierte Läsionen in drei Kategorien einteilen: 1) kleine, flache Läsionen, bei denen es sich eindeutig um Aderhautnävi handelt; 2) kleine Läsionen mit einer Größe von <2,5 mm, die orangefarbenes Pigment oder subretinale Flüssigkeit oder einen der anderen Faktoren aufweisen können, die den Verdacht auf Bösartigkeit wecken – die so genannten unbestimmten Läsionen; und 3) kuppel- oder pilzförmige Aderhauttumoren mit einer Größe von mehr als/gleich 2,5 mm, bei denen es sich eindeutig um Melanome handelt. Die Behandlung der indeterminierten Läsionen ist nach wie vor umstritten, und die Bewertung und Behandlung dieser Läsionen wird am besten von Augenonkologen durchgeführt. Eine klinische Studie, in der eine frühzeitige Behandlung mit einer verzögerten Behandlung von unbestimmten Läsionen verglichen wird, ist aufgrund der großen Anzahl von Patienten und der für schlüssige Ergebnisse erforderlichen Dauer der Nachbeobachtung möglicherweise nicht durchführbar. Angesichts der laufenden Fortschritte in der Molekulardiagnostik liegt die größte Hoffnung auf eine Verlängerung der Überlebenszeit von Patienten mit Aderhautmelanom in der Entwicklung wirksamer Behandlungen für metastasierende Erkrankungen und in der Suche nach Biomarkern, die eine bösartige Transformation genauer vorhersagen können.
Dr. Eichhorn-Mulligan ist in der Facharztausbildung für Augenheilkunde an der Harvard Medical School. Dr. Kim ist Assistenzprofessor in der Abteilung für Augenheilkunde der Harvard Medical School, Retina Service, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Choroidale Nävi in einer weißen Bevölkerung – die Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Klinisches Spektrum von choroidalen Nävi basierend auf dem Alter bei der Präsentation in 3.422 konsekutiven Augen. Ophthalmology 2007: Dec 5 .
3. Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Sehverlust in Verbindung mit choroidalen Nävi. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Clinical study of choroidal nevi. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Gesichtsfeldstudien bei gutartigen Aderhautmelanomata. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Sehschärfe bei 3.422 konsekutiven Augen mit choroidalem Nävus. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Histogenese von malignen Melanomen der Aderhaut. II. Beziehung von Aderhautnävi zu malignen Melanomen. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Benigne Nävi und maligne Melanome der Aderhaut. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Absence of change in choroidal nevi across 5 years in an older population. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Vergrößerung eines histologisch dokumentierten choroidalen Nävus. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Histopathologie des dokumentierten Wachstums bei kleinen melanozytären Aderhauttumoren. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Risikofaktoren für das Wachstum und die Metastasierung kleiner choroidaler melanozytärer Läsionen. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combination of clinical factors predictive of growth of small choroidal melanocytic tumors. Arch Ophthalmol 2000;118:360-364.
15. The Collaborative Ocular Melanoma Study Group. Faktoren, die das Wachstum und die Behandlung von kleinen Aderhautmelanomen vorhersagen. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Natural history of indeterminate pigmented choroidal tumors. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Optische Kohärenztomographie bei der Beurteilung von Netzhautveränderungen im Zusammenhang mit verdächtigen melanozytären Aderhauttumoren. Am J Ophthalmol 2004;137:90-95.
18. The Collaborative Ocular Melanoma Study Group. Die randomisierte COMS-Studie zur Jod-125-Brachytherapie des Aderhautmelanoms: V. Zwölf-Jahres-Mortalitätsraten und prognostische Faktoren: COMS-Bericht Nr. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, The Collaborative Ocular Melanoma Study Group. Die randomisierte Studie der Collaborative Ocular Melanoma Study (COMS) zur Bestrahlung von großen Aderhautmelanomen vor der Nukleation: IV. Zehn-Jahres-Mortalitätsergebnisse und prognostische Faktoren. COMS-Bericht Nr. 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortalität bei Patienten mit kleinem Aderhautmelanom. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Ergebnisse der Jod-125-Plaque-Strahlentherapie nach Erstbeobachtung von vermuteten kleinen Aderhautmelanomen. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.