Knut Eichhorn-Mulligan, MD, PhD en Ivana K. Kim, MD, Boston
Choroïdale nevi, vooral de kleine, komen vaak voor. Schattingen van hun prevalentie variëren van 5 tot 10 procent van de algemene bevolking. De Blue Mountains Eye Study registreerde choroïdale nevi bij 6,5 procent van een prospectief bestudeerde populatie van voornamelijk blanke Australiërs van middelbare leeftijd.1 Choroïdale melanomen daarentegen zijn gelukkig een zeldzame entiteit, met een geschatte incidentie van ongeveer zes per miljoen. Niettemin is choroïdaal melanoom de meest voorkomende primaire intraoculaire maligniteit bij volwassenen, en een snelle en nauwkeurige diagnose is belangrijk.
Karakteristieken van nevi
Histologisch gezien zijn nevi goedaardige neoplasma’s van de melanocyten die zich in de buitenste lagen van het vaatvlies bevinden. Ze verschijnen meestal als een vlakke, leigrijze laesie onder het netvlies. In 10% van de gevallen kunnen nevi echter volledig ongepigmenteerd zijn.2 Het risico op maligne transformatie wordt vrij laag ingeschat.3 Toch kunnen nevi visuele stoornissen veroorzaken, vooral als ze zich in de buurt van de fovea bevinden. Door de bovenliggende choriocapillaris samen te drukken, kunnen dikkere nevi de bloedstroom naar de RPE en de buitenste lagen van het netvlies belemmeren en leiden tot degeneratie van de RPE en de fotoreceptor.4 Nevi zijn in verband gebracht met gezichtsvelddefecten bij een verrassend groot aantal patiënten, hoewel deze defecten, als ze perifeer zijn, niet symptomatisch worden.5,6 Meer visueel significante complicaties die zijn waargenomen in verband met goedaardige nevi zijn onder andere sereuze loslatingen van de RPE en het netvlies en choroïdale neovascularisatie.4 Uit een recent onderzoek naar de visuele functie bij meer dan 3400 patiënten met nevi in het Wills Eye Hospital bleek dat het geschatte risico op gezichtsverlies na 15 jaar 2% was bij patiënten met extrafoveale nevi, maar 26% bij patiënten met subfoveolaire nevi.7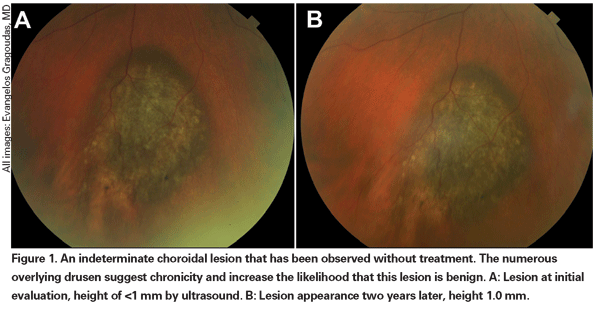
Of melanomen ontstaan uit reeds bestaande nevi, of in feite een afzonderlijke entiteit vormen, is enigszins omstreden. Analyse van uitgepluisde ogen heeft histologische kenmerken aangetoond die kenmerkend zijn voor nevi binnen de randen van kwaadaardige melanomen, wat suggereert dat ten minste sommige melanomen kunnen ontstaan uit kwaadaardige transformatie binnen reeds bestaande nevi.8 Niettemin wordt het risico dat een choroïdale nevus in een melanoom verandert over het algemeen als uiterst gering beschouwd. Schattingen van de jaarlijkse percentages van kwaadaardige transformatie variëren van één op 4.800 tot één op 8.800.3,9
In het algemeen vergroten kleine choroïdale nevi zelden. In de Blue Mountains-studie vertoonde slechts één van de 160 nevi (gemiddelde diameter 1,25 mm), waarvoor een follow-up van ten minste vijf jaar beschikbaar was, een lichte toename in diameter.10 Er zijn echter verschillende meldingen van histologisch bevestigde choroïdale nevi die een progressieve vergroting vertoonden, maar bij zorgvuldig onderzoek geen kwaadaardige kenmerken vertoonden.11,12 Bovendien stelden Carol Shields, MD, en collega’s in een analyse van meer dan 2.500 ogen die werden gevolgd in een tertiaire verwijspraktijk, een vergroting vast bij 3 tot 4 procent van de nevi zonder kenmerken van kwaadaardige transformatie.2 De nevi in dit klinische cohort waren significant groter bij aanvang dan die in het bevolkingsonderzoek in de Blue Mountains, met een gemiddelde diameter van ongeveer 5 mm.

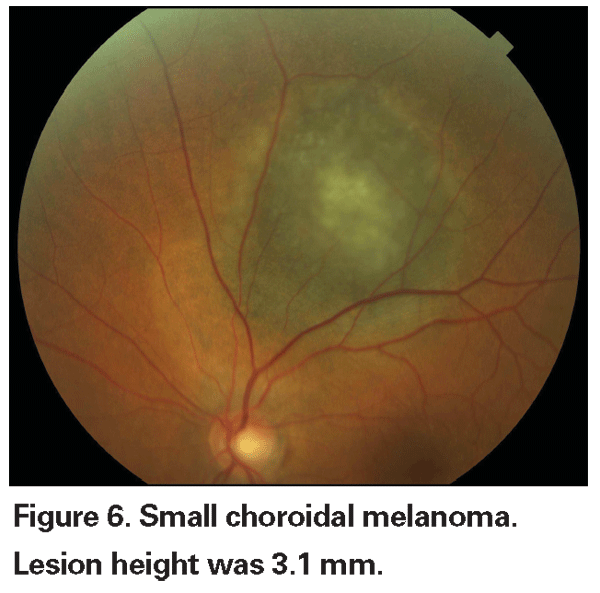
Opsporen van kleine melanomen
Gepigmenteerde choroïdale laesies die licht verhoogd zijn, worden indeterminate laesies genoemd en vormen een uitdaging met betrekking tot diagnose en behandeling. Gezien de risico’s en beperkingen met betrekking tot het verkrijgen van histologische bevestiging van maligniteit, moeten oogartsen vertrouwen op klinische kenmerken die zijn geïdentificeerd als voorspellend voor groei en metastase om kleine melanomen te kunnen onderscheiden van verhoogde choroidale melanocytaire tumoren die waarschijnlijk goedaardig zijn. Dr. Shields en collega’s identificeerden op basis van retrospectieve analyses van ongeveer 1300 patiënten vijf factoren die geassocieerd zijn met het risico op groei van kleine choroïdale melanocytaire laesies met een dikte van minder dan 3 mm.13 Deze factoren waren: 1) tumordikte groter dan 2,0 mm; 2) subretinale vloeistof; 3) visuele symptomen; 4) oranje pigment; 5) posterieure tumormarge die de discus raakt. Lesiegroei werd waargenomen bij 4 procent van de patiënten zonder een van deze risicofactoren, bij 36 procent van de patiënten met één risicofactor, en bij meer dan 50 procent van de patiënten met drie of meer factoren.14 Klinische factoren die geassocieerd werden met een verhoogd risico op metastase waren onder meer: 1) een posterieure marge die de discus raakt; 2) gedocumenteerde groei; en 3) toegenomen tumordikte (groter dan/gelijk aan 1,1 mm).13 De observatiestudie van kleine tumoren, uitgevoerd door de Collaborative Ocular Melanoma Study (COMS) Group, identificeerde vergelijkbare risicofactoren die geassocieerd zijn met tumorgroei; namelijk 1) grotere apicale tumordikte, 2) grotere initiële basale diameter, 3) aanwezigheid van oranje pigment, 4) afwezigheid van drusen, en 5) afwezigheid van retinale pigment epitheliale verandering grenzend aan de tumor.15 Deze laatste twee factoren bevestigen de klinische observatie dat de aanwezigheid van drusen en pigmentveranderingen indicatoren zijn van chroniciteit, en daarom eerder worden gezien over slapende, goedaardige laesies. 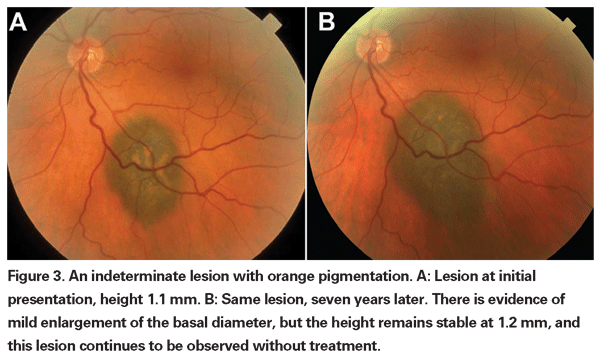
Imagingkenmerken kunnen ook nuttig zijn bij de beoordeling van de kans op maligniteit. De aanwezigheid van een interne rustige zone op B-scan ultrasonografie en hot spots op fluoresceïne-angiografie zijn voorspellers van tumorgroei gebleken.16 De rol van optische coherentietomografie bij de evaluatie van choroïdale laesies wordt ook onderzocht. Gabriella Espinoza, MD, en collega’s hebben voorgesteld dat OCT waardevol kan zijn om een onderscheid te maken tussen actieve subretinale vloeistof, waarbij het netvlies boven de laesie verhoogd is maar er verder normaal uitziet, en chronische veranderingen zoals het dunner worden van het netvlies of intraretinale cysten. In hun kleine serie vonden zij een correlatie tussen een actieve subretinale vloeistof op OCT en gedocumenteerde tumorgroei.17
Vroege behandeling versus observatie
Early Treatment vs. Observatie
Toen enucleatie de enige geaccepteerde vorm van behandeling voor melanoom was, werd observatie tot gedocumenteerde groei aanbevolen voor kleine tumoren die bij eerste presentatie niet met zekerheid als melanoom konden worden gediagnosticeerd. Nu er therapieën beschikbaar zijn die de oogbol sparen en waarvan de doeltreffendheid is aangetoond, kan worden gepleit voor een vroegere behandeling van deze onbestemde laesies. Uit de gegevens van de COMS-studies blijkt dat de mortaliteit als gevolg van melanoom varieert met de grootte van de tumor op het ogenblik van de behandeling. Voor middelgrote tumoren (gedefinieerd als tumoren met een apicale hoogte van 2,5 tot 10 mm en een grootste basale diameter tot 16 mm) bedroeg de melanoom-specifieke mortaliteit 10 % na vijf jaar en 18 % na tien jaar.18 Voor grote tumoren (die groter zijn dan de groottecriteria voor middelgrote tumoren, hetzij in apicale hoogte, hetzij in grootste basale diameter; of peripapillaire tumoren met een apicale hoogte van meer dan 8 mm), stegen de percentages tot ongeveer 27 procent na vijf jaar en tot 40 procent na tien jaar.19 Bovendien is, zoals hierboven vermeld, aangetoond dat gedocumenteerde groei vóór de behandeling een risicofactor voor metastase is. Groei kan echter een marker zijn voor agressievere tumoren, en het is niet bewezen dat het eerder behandelen van deze tumoren de mortaliteit verlaagt.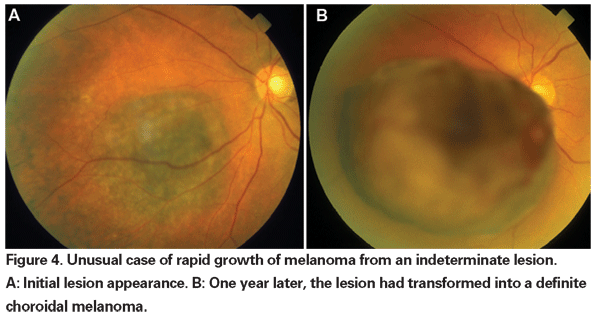
De huidige radiotherapiemethoden maken een effectieve lokale tumorcontrole met behoud van de oogbol mogelijk, maar de morbiditeit van het gezichtsvermogen is nog steeds hoog. Daarom moet het sterfterisico door zorgvuldige observatie voorafgaand aan de behandeling van onbestemde laesies worden afgewogen tegen de gevolgen van gezichtsverlies als gevolg van de therapie. In het COMS-observatieonderzoek van kleine tumoren waren er zes sterfgevallen ten gevolge van melanoom in een groep van 67 patiënten met tumoren die na een eerste observatieperiode werden behandeld.20 Slechts twee van deze sterfgevallen deden zich voor binnen vijf jaar na de inschrijving, wat resulteerde in een melanoom-specifiek sterftecijfer van ongeveer 3% na vijf jaar. Meer recent meldden onderzoekers van het Bascom Palmer Eye Institute een vijf-jaars melanoom-specifieke mortaliteit van 3,9 procent in een kleine groep patiënten met vermoedelijk choroïdaal melanoom die werden geobserveerd op groei of ontwikkeling van oranje pigment voorafgaand aan behandeling met plaque radiotherapie.21 Deze studies suggereren lage mortaliteitscijfers in verband met uitgestelde behandeling voor onbestemde laesies. Bovendien toonde een kleine retrospectieve serie geen toename in melanoom-specifieke mortaliteit tussen direct behandelde en initieel geobserveerde patiënten.22 Tot op heden is er geen bewijs om een overlevingsvoordeel aan te tonen van eerdere versus uitgestelde behandeling van kleine tumoren die niet definitief als melanoom kunnen worden gediagnosticeerd. Daarom is het niet duidelijk dat het opofferen van het gezichtsvermogen bij een groter aantal patiënten met onbestemde laesies beslist meer levens zal redden.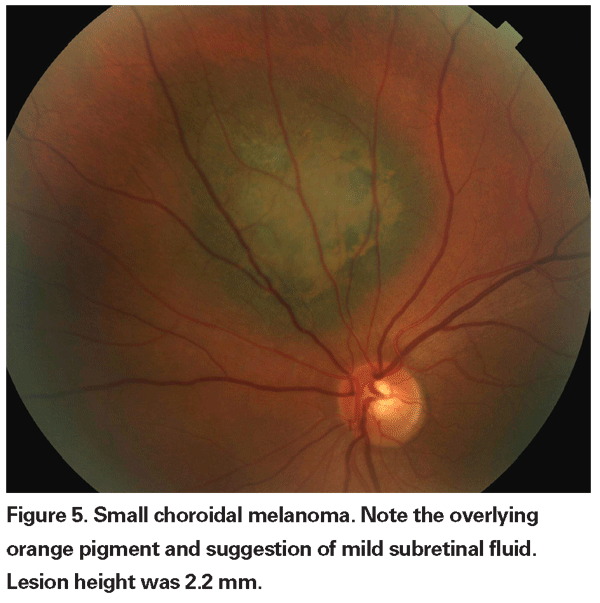
Samengevat kunnen choroidale gepigmenteerde laesies in drie categorieën worden ingedeeld: 1) kleine, vlakke laesies die duidelijk choroidale nevi zijn; 2) kleine laesies met verhoging <2,5 mm die oranje pigment of subretinale vloeistof kunnen hebben of een van de andere factoren die de verdenking op maligniteit doen rijzen – de zogenaamde onbepaalde laesies; en 3) koepel- of paddestoelvormige choroidale tumoren groter dan/gelijk aan 2,5 mm die duidelijk melanomen zijn. Het is de behandeling van de onbepaalde letsels die nog steeds een punt van controverse blijft, en de evaluatie en het beheer van deze letsels wordt het best uitgevoerd door oculaire oncologen. Een klinische studie die een vroege behandeling vergelijkt met een uitgestelde behandeling voor onbepaalde letsels is wellicht niet haalbaar omwille van het grote aantal patiënten en de lengte van de follow-up die nodig is voor sluitende resultaten. Met de voortdurende vooruitgang in moleculaire diagnostische technieken, ligt de beste hoop voor het vergroten van de overleving van patiënten met choroïdaal melanoom in de ontwikkeling van effectieve behandelingen voor metastatische ziekte en in de zoektocht naar biomarkers die maligne transformatie nauwkeuriger zouden kunnen voorspellen.
Dr. Eichhorn-Mulligan is in opleiding in de oogheelkunde aan de Harvard Medical School. Dr. Kim is assistent-professor bij de afdeling Oogheelkunde aan de Harvard Medical School, Retina Service, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Choroidal nevi in a white population – the Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Klinisch spectrum van choroïdale nevi op basis van leeftijd bij presentatie in 3.422 opeenvolgende ogen. Ophthalmology 2007: Dec 5 .
3. Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Visueel verlies geassocieerd met choroïdale nevi. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Klinische studie van choroïdale nevi. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Visual field studies of benign choroidal melanomata. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Gezichtsscherpte in 3.422 opeenvolgende ogen met choroïdale nevus. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Histogenese van maligne melanomen van de uvea. II. Relatie van uveale nevi tot maligne melanomen. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Benigne nevi and maligne melanomas of the choroid. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Absence of change in choroidal nevi across 5 years in an older population. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Uitbreiding van een histologisch gedocumenteerde choroïdale nevus. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Histopathology of documented growth in small melanocytic choroidal tumors. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Risk factors for growth and metastasis of small choroidal melanocytic lesions. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combination of clinical factors predictive of growth of small choroidal melanocytic tumors. Arch Ophthalmol 2000;118:360-364.
15. De Collaborative Ocular Melanoma Study Group. Factors predictive of growth and treatment of small choroidal melanoma. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Natural history of indeterminate pigmented choroidal tumors. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Optical coherence tomography in the evaluation of retinal changes associated with suspicious choroidal melanocytic tumors. Am J Ophthalmol 2004;137:90-95.
18. De Collaborative Ocular Melanoma Study Group. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twaalf-jaars mortality rates and prognostic factors: COMS rapport nr. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, De Collaborative Ocular Melanoma Study Group. De Collaborative Ocular Melanoma Study (COMS) gerandomiseerde studie van pre-enucleatie bestraling van groot choroïdaal melanoom: IV. Tien-jaars mortaliteitsbevindingen en prognostische factoren. COMS rapport nr. 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortality in patients with small choroidal melanoma. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Outcomes of iodine 125 plaque radiotherapy after initial observation of suspected small choroidal melanomas. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.