Knut Eichhorn-Mulligan, MD, PhD i Ivana K. Kim, MD, Boston
Złośliwe znamiona, zwłaszcza małe, są powszechne. Szacuje się, że ich występowanie waha się od 5 do 10 procent populacji ogólnej. W badaniu Blue Mountains Eye Study odnotowano występowanie znamion naczyniówki u 6,5 procent badanej prospektywnie populacji głównie białych Australijczyków w średnim wieku.1 Czerniaki naczyniówki, z drugiej strony, są na szczęście rzadką jednostką, z szacowaną częstością występowania około sześciu na milion. Niemniej jednak, czerniak naczyniówki jest najczęstszym pierwotnym wewnątrzgałkowym nowotworem złośliwym u dorosłych, a szybkie i dokładne rozpoznanie jest bardzo ważne.
Charakterystyka znamion
Histologicznie, znamiona są łagodnymi nowotworami melanocytów, które rezydują w zewnętrznych warstwach naczyniówki. Zazwyczaj pojawiają się jako płaskie, łupkowo-szare zmiany pod siatkówką. Jednakże, znamiona mogą być całkowicie pozbawione pigmentu nawet w 10% przypadków.2 Ryzyko transformacji złośliwej jest szacowane na dość niskie.3 Niemniej jednak, znamiona mogą potencjalnie powodować zaburzenia widzenia, szczególnie jeśli są zlokalizowane w pobliżu fovea. Uciskając choriocapillaris, grubsze znamiona mogą utrudniać przepływ krwi do RPE i zewnętrznych warstw siatkówki oraz prowadzić do degeneracji RPE i fotoreceptorów.4 U zaskakująco dużej liczby pacjentów znamiona wiążą się z ubytkami pola widzenia, chociaż jeśli są one obwodowe, mogą nie dawać objawów.5,6 Do bardziej istotnych powikłań, które obserwowano w związku z łagodnymi znamionami, należą surowicze odwarstwienia RPE i siatkówki oraz neowaskularyzacja naczyniówki.4 Niedawny przegląd funkcji wzrokowych u ponad 3400 pacjentów ze znamionami w Wills Eye Hospital wykazał, że szacowane ryzyko utraty wzroku w ciągu 15 lat wynosiło 2 procent u pacjentów ze znamionami pozawęźlowymi, ale 26 procent u pacjentów ze znamionami podpowięziowymi.7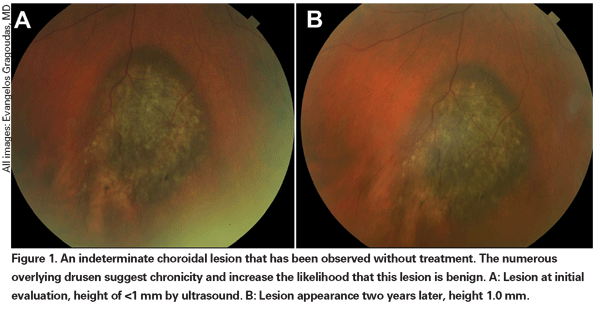
Czy czerniaki powstają z istniejących wcześniej znamion, czy też są w rzeczywistości odrębną jednostką, jest nieco kontrowersyjne. Analiza enukleowanych oczu wykazała cechy histologiczne charakterystyczne dla znamion w obrębie brzegów czerniaków złośliwych, co sugeruje, że przynajmniej niektóre czerniaki mogą ewoluować z transformacji złośliwej w obrębie wcześniej istniejących znamion.8 Niemniej jednak ryzyko przekształcenia się znamienia naczyniówki w czerniaka jest ogólnie uważane za niezwykle małe. Szacunkowe roczne wskaźniki transformacji złośliwej wahają się od jednego na 4 800 do jednego na 8 800.3,9
Na ogół małe znamiona naczyniówki rzadko ulegają powiększeniu. W badaniu Blue Mountains spośród 160 znamion (średnia średnica 1,25 mm), dla których dostępna była co najmniej pięcioletnia obserwacja, tylko jedno wykazało niewielki wzrost średnicy.10 Istnieje jednak kilka doniesień o potwierdzonych histologicznie znamionach naczyniówki, które wykazywały stopniowe powiększanie się, ale przy dokładnym badaniu nie wykazywały cech złośliwości.11,12 Ponadto w analizie ponad 2500 oczu śledzonych w trzeciorzędowej praktyce referencyjnej Carol Shields, MD, i współpracownicy zauważyli powiększenie w 3 do 4 procentach znamion bez cech transformacji złośliwej.2 Znamiona w tej klinicznej kohorcie były znacznie większe na początku niż te w populacyjnym badaniu Blue Mountains, średnio o średnicy około 5 mm.

Wykrywanie małych czerniaków
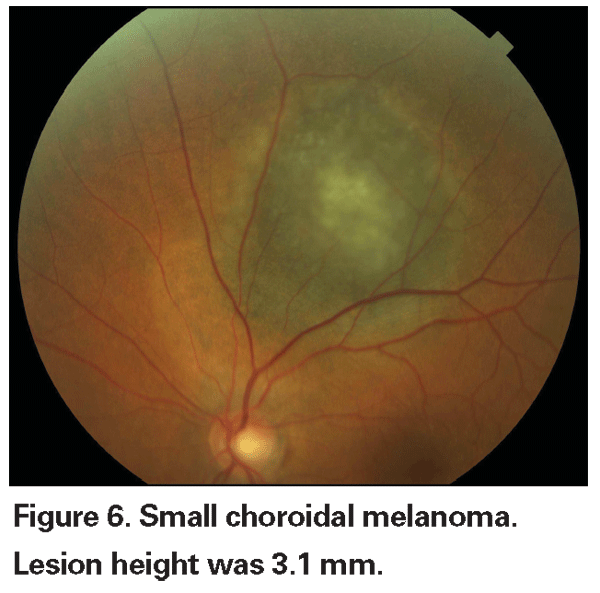
Pigmentowane zmiany naczyniówki, które są łagodnie uniesione mogą być nazywane zmianami nieokreślonymi i stanowią wyzwanie w odniesieniu do diagnozy i zarządzania. Biorąc pod uwagę ryzyko i ograniczenia związane z uzyskaniem histologicznego potwierdzenia złośliwości, okuliści muszą polegać na cechach klinicznych zidentyfikowanych jako predykcyjne dla wzrostu i przerzutów w celu odróżnienia małych czerniaków od uniesionych melanocytowych guzów naczyniówki, które są prawdopodobnie łagodne. Dr Shields i współpracownicy zidentyfikowali pięć czynników związanych z ryzykiem wzrostu małych zmian melanocytowych w naczyniówce o grubości mniejszej niż 3 mm na podstawie retrospektywnych analiz około 1300 pacjentów.13 Czynnikami tymi były: 1) grubość guza większa niż 2,0 mm; 2) płyn podsiatkówkowy; 3) objawy wzrokowe; 4) pomarańczowy pigment; 5) tylny margines guza dotykający tarczy. Wzrost zmiany obserwowano u 4 procent pacjentów, u których nie występował żaden z tych czynników ryzyka, u 36 procent pacjentów z jednym czynnikiem ryzyka i u ponad 50 procent pacjentów z trzema lub więcej czynnikami.14 Czynniki kliniczne związane ze zwiększonym ryzykiem przerzutów obejmowały: 1) tylny margines dotykający tarczy; 2) udokumentowany wzrost; oraz 3) zwiększoną grubość guza (większą/równą 1,1 mm).13 W badaniu obserwacyjnym dotyczącym małych guzów przeprowadzonym przez Collaborative Ocular Melanoma Study (COMS) Group zidentyfikowano podobne czynniki ryzyka związane ze wzrostem guza, a mianowicie 1) większą grubość wierzchołka guza, 2) większą początkową średnicę podstawną, 3) obecność pomarańczowego pigmentu, 4) brak druz i 5) brak zmiany nabłonka barwnikowego siatkówki przylegającej do guza.15 Te dwa ostatnie czynniki potwierdzają obserwację kliniczną, że obecność druz i zmian barwnikowych są wskaźnikami przewlekłości, a zatem są bardziej prawdopodobne w przypadku zmian uśpionych, łagodnych. 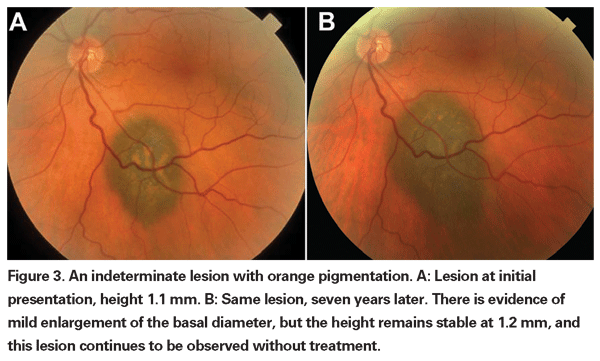
Charakterystyka obrazowania może być również pomocna w ocenie potencjału złośliwości. Wykazano, że obecność wewnętrznej cichej strefy w ultrasonografii B-scan i gorące punkty w angiografii fluoresceinowej są predyktorami wzrostu guza.16 Rola optycznej koherentnej tomografii w ocenie zmian naczyniówki jest również badana. Gabriella Espinoza i współpracownicy zaproponowali, że OCT może być cenna w różnicowaniu między aktywnym płynem podsiatkówkowym, w którym siatkówka nad zmianą jest uniesiona, ale poza tym ma normalny wygląd, a zmianami przewlekłymi, takimi jak ścieńczenie siatkówki lub torbiele wewnątrzsiatkówkowe. W swojej małej serii stwierdzili oni korelację pomiędzy aktywnym płynem podsiatkówkowym w OCT a udokumentowanym wzrostem guza.17
Wczesne leczenie vs. Obserwacja
Wczesne leczenie vs. Obserwacja
Kiedy enukleacja była jedyną akceptowaną formą leczenia czerniaka, obserwacja do czasu udokumentowanego wzrostu była zalecana w przypadku małych guzów, które nie mogły być definitywnie zdiagnozowane jako czerniaki przy pierwszej prezentacji. Obecnie, wraz z dostępnością i wykazaną skutecznością terapii oszczędzających kulę ziemską, można wysunąć argument za wcześniejszym leczeniem tych nieokreślonych zmian. Dane z badań COMS ujawniają, że śmiertelność związana z czerniakiem różni się w zależności od wielkości guza w momencie rozpoczęcia leczenia. W przypadku średnich guzów (zdefiniowanych jako guzy o wysokości wierzchołkowej od 2,5 do 10 mm i największej średnicy podstawy do 16 mm) śmiertelność związana z czerniakiem wynosiła 10% w ciągu pięciu lat i 18% w ciągu 10 lat.18 W przypadku dużych guzów (przekraczających kryteria wielkości dla średnich guzów w wysokości wierzchołka lub największej średnicy podstawy; lub guzów okołoguzowych o wysokości wierzchołka większej niż 8 mm), wskaźniki te wzrosły do około 27 procent w ciągu pięciu lat i 40 procent w ciągu 10 lat.19 Ponadto, jak wspomniano powyżej, udokumentowany wzrost przed leczeniem okazał się czynnikiem ryzyka przerzutów. Jednak wzrost może być markerem dla bardziej agresywnych guzów i nie udowodniono, że wcześniejsze leczenie tych guzów zmniejsza śmiertelność.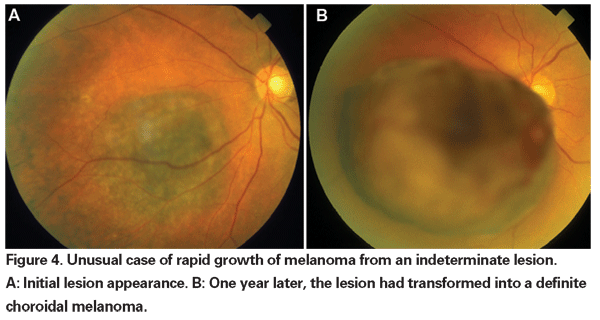
Nasze obecne metody radioterapii pozwalają na skuteczną miejscową kontrolę guza z zachowaniem widzenia, ale zachorowalność na nowotwory wzroku jest nadal wysoka. Dlatego konieczne jest rozważenie ryzyka śmiertelności związanego z uważną obserwacją przed leczeniem zmian nieokreślonych w stosunku do konsekwencji utraty wzroku spowodowanej leczeniem. W badaniu obserwacyjnym COMS dotyczącym małych guzów odnotowano sześć zgonów związanych z czerniakiem w grupie 67 pacjentów z guzami, którzy byli leczeni po początkowym okresie obserwacji.20 Tylko dwa z tych zgonów nastąpiły w ciągu pięciu lat po włączeniu do badania, co daje przybliżony pięcioletni wskaźnik śmiertelności specyficzny dla czerniaka wynoszący 3%. Niedawno badacze z Bascom Palmer Eye Institute zgłosili pięcioletnią śmiertelność swoistą dla czerniaka wynoszącą 3,9% w małej grupie pacjentów z podejrzeniem czerniaka naczyniówki, obserwowanych pod kątem wzrostu lub rozwoju pomarańczowego pigmentu przed leczeniem radioterapią plazmocytową.21 Badania te sugerują niską śmiertelność związaną z opóźnionym leczeniem zmian nieokreślonych. Ponadto w małej retrospektywnej serii nie wykazano zwiększenia śmiertelności swoistej dla czerniaka między pacjentami leczonymi szybko i obserwowanymi początkowo.22 Do tej pory nie ma dowodów wskazujących na korzyść w zakresie przeżycia wynikającą z wcześniejszego w porównaniu z opóźnionym leczeniem małych guzów, które nie mogą być ostatecznie zdiagnozowane jako czerniaki. Dlatego nie jest jasne, czy poświęcenie wzroku u większej liczby pacjentów z nieokreślonymi zmianami na pewno uratuje więcej istnień ludzkich.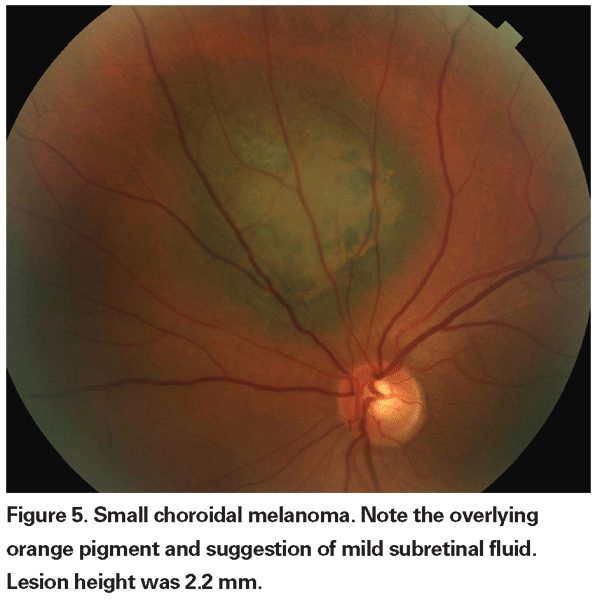
Podsumowując, naczyniówkowe zmiany barwnikowe można podzielić na trzy kategorie: 1) małe, płaskie zmiany, które są wyraźnie znamionami naczyniówkowymi; 2) małe zmiany z wyniesieniem <2,5 mm, które mogą mieć pomarańczowy pigment lub płyn podsiatkówkowy lub jeden z innych czynników budzących podejrzenie złośliwości – tzw. zmiany nieokreślone; oraz 3) kopulaste lub grzybkowate guzy naczyniówki większe/równe 2,5 mm, które są wyraźnie czerniakami. To właśnie leczenie zmian nieokreślonych pozostaje nadal przedmiotem kontrowersji, a ocena i leczenie tych zmian jest najlepiej przeprowadzane przez onkologów okulistycznych. Badanie kliniczne porównujące wczesne i opóźnione leczenie zmian nieokreślonych może być niewykonalne ze względu na dużą liczbę pacjentów i długość obserwacji niezbędną do uzyskania rozstrzygających wyników. Wobec ciągłego postępu w diagnostyce molekularnej największą nadzieję na zwiększenie przeżywalności chorych na czerniaka naczyniówki daje opracowanie skutecznych metod leczenia choroby przerzutowej oraz poszukiwanie biomarkerów, które mogłyby precyzyjniej prognozować transformację złośliwą.
Dr Eichhorn-Mulligan jest w trakcie rezydentury z okulistyki w Harvard Medical School. Dr Kim jest adiunktem w Departamencie Okulistyki w Harvard Medical School, Retina Service, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Choroidal nevi in a white population – the Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Clinical spectrum of choroidal nevi based on age at presentation in 3,422 consecutive eyes. Ophthalmology 2007: Dec 5 .
3. Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Visual loss associated with choroidal nevi. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Clinical study of choroidal nevi. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Visual field studies of benign choroidal melanomata. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Visual acuity in 3,422 consecutive eyes with choroidal nevus. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Histogeneza czerniaków złośliwych błony naczyniowej oka. II. Relationship of uveal nevi to malignant melanomas. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Benign nevi and malignant melanomas of the choroid. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Absence of change in choroidal nevi across 5 years in an older population. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Enlargement of a histologically documented choroidal nevus. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Histopathology of documented growth in small melanocytic choroidal tumors. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Risk factors for growth and metastasis of small choroidal melanocytic lesions. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combination of clinical factors predictive of growth of small choroidal melanocytic tumors. Arch Ophthalmol 2000;118:360-364.
15. The Collaborative Ocular Melanoma Study Group. Factors predictive of growth and treatment of small choroidal melanoma. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Natural history of indeterminate pigmented choroidal tumors. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Optical coherence tomography in the evaluation of retinal changes associated with suspicious choroidal melanocytic tumors. Am J Ophthalmol 2004;137:90-95.
18. The Collaborative Ocular Melanoma Study Group. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twelve-year mortality rates and prognostic factors: COMS report No. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, The Collaborative Ocular Melanoma Study Group. The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radiation of large choroidal melanoma: IV. Dziesięcioletnie wyniki śmiertelności i czynniki prognostyczne. Raport COMS nr 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortality in patients with small choroidal melanoma. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Outcomes of iodine 125 plaque radiotherapy after initial observation of suspected small choroidal melanomas. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.