Knut Eichhorn-Mulligan, MD, PhD și Ivana K. Kim, MD, Boston
Nevii coroidali, în special cei mici, sunt comuni. Estimările privind prevalența lor variază între 5 și 10 la sută din populația generală. Studiul Blue Mountains Eye Study a înregistrat nevi coroidieni la 6,5 la sută dintr-o populație studiată prospectiv, formată în majoritate din australieni albi de vârstă mijlocie.1 Melanoamele coroidiene, pe de altă parte, sunt, din fericire, o entitate rară, cu o incidență estimată de aproximativ șase la un milion. Cu toate acestea, melanomul coroidal este cea mai frecventă afecțiune malignă intraoculară primară la adulți, iar un diagnostic prompt și precis este important.
Caracteristicile nevi
Histologic, nevi sunt neoplasme benigne ale melanocitelor care rezidă în straturile externe ale coroidei. Ele apar de obicei ca o leziune plată, de culoare cenușie argintie sub retină. Cu toate acestea, nevi pot fi complet nepigmentați în până la 10 la sută din cazuri.2 Se estimează că riscul de transformare malignă este destul de scăzut.3 Cu toate acestea, nevi au potențialul de a provoca disfuncții vizuale, în special dacă sunt localizați în apropierea foveei. Prin comprimarea coriocapilarelor suprapuse, nevi mai groși pot obstrucționa fluxul sanguin către RPE și straturile exterioare ale retinei și pot duce la degenerarea RPE și a fotoreceptorilor.4 Nevii au fost asociați cu defecte ale câmpului vizual la un număr surprinzător de mare de pacienți, deși, dacă sunt periferice, este posibil ca aceste deficite să nu devină simptomatice.5,6 Complicațiile mai semnificative din punct de vedere vizual care au fost observate în asociere cu nevi benigni includ detașările seroase ale RPE și ale retinei și neovascularizarea coroidiană.4 O analiză recentă a funcției vizuale la peste 3.400 de pacienți cu nevi de la Wills Eye Hospital a arătat că riscul estimat de pierdere a vederii pe o perioadă de 15 ani a fost de 2 la sută la pacienții cu nevi extrafoveali, dar de 26 la sută pentru pacienții cu nevi subfoveolari.7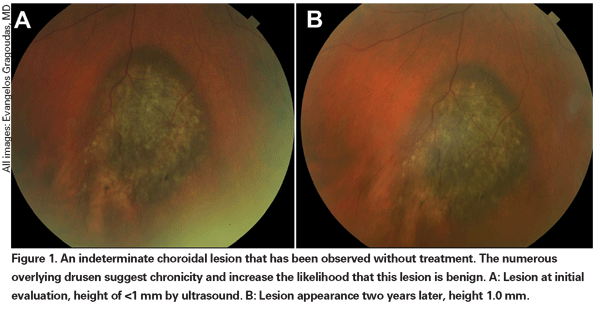
Dacă melanoamele apar din nevi preexistenți, sau sunt de fapt o entitate separată, este oarecum controversat. Analiza ochilor enucleați a demonstrat trăsături histologice caracteristice neviilor în cadrul marginilor melanoamelor maligne, sugerând că cel puțin unele melanoame pot evolua din transformarea malignă în cadrul unor nevi preexistenți.8 Cu toate acestea, riscul ca un nev coroidian să se transforme într-un melanom este în general considerat extrem de scăzut. Estimările privind ratele anuale de transformare malignă variază între una la 4.800 și una la 8.800.3,9
În general, nevi coroidieni mici se măresc rar. În studiul Blue Mountains, din 160 de nevi (cu diametrul mediu de 1,25 mm), pentru care au fost disponibili cel puțin cinci ani de urmărire, doar unul singur a prezentat o ușoară creștere a diametrului.10 Cu toate acestea, există mai multe rapoarte de nevi coroidieni confirmați histologic care au prezentat o mărire progresivă, dar care nu prezentau caracteristici maligne la o analiză atentă.11,12 Mai mult decât atât, într-o analiză a peste 2.500 de ochi urmăriți într-un cabinet de referință terțiar, Carol Shields, MD, și colegii săi au observat mărirea în 3 până la 4 la sută din nevi fără caracteristici de transformare malignă.2 Nevii din această cohortă bazată pe clinică au fost semnificativ mai mari la momentul inițial decât cei din studiul Blue Mountains bazat pe populație, având un diametru mediu de aproximativ 5 mm.

Detectarea melanoamelor mici
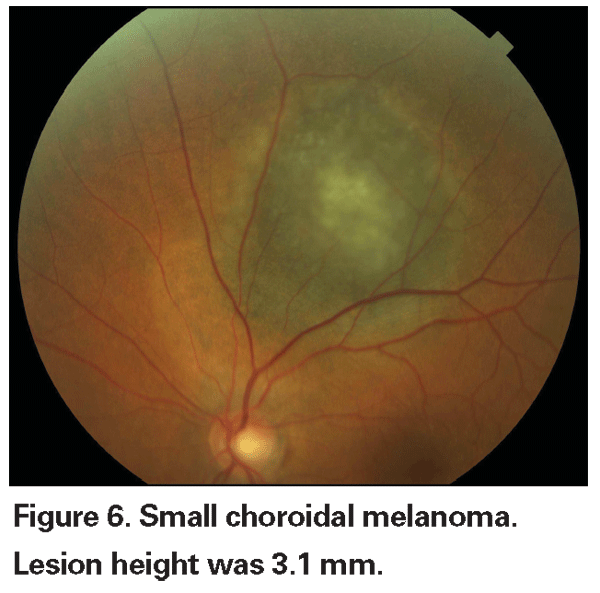
Leziunile coroidiene pigmentate care sunt ușor crescute pot fi numite leziuni nedeterminate și reprezintă o provocare în ceea ce privește diagnosticul și managementul. Având în vedere riscurile și limitările în ceea ce privește obținerea confirmării histologice a malignității, oftalmologii trebuie să se bazeze pe caracteristicile clinice identificate ca fiind predictive pentru creștere și metastaze pentru a diferenția micile melanoame de tumorile melanocitice coroidiene crescute care sunt probabil benigne. Dr. Shields și colegii săi au identificat cinci factori asociați cu riscul de creștere a leziunilor melanocitice coroidiene mici, cu o grosime mai mică de 3 mm, în urma unor analize retrospective efectuate pe aproximativ 1.300 de pacienți13 : 1) grosimea tumorii mai mare de 2,0 mm; 2) lichid subretinian; 3) simptome vizuale; 4) pigment portocaliu; 5) marginea posterioară a tumorii care atinge discul. Creșterea leziunii a fost observată la 4 la sută dintre pacienții care nu prezentau niciunul dintre acești factori de risc, la 36 la sută dintre cei cu un singur factor de risc și la peste 50 la sută dintre cei cu trei sau mai mulți factori.14 Factorii clinici asociați cu un risc crescut de metastază au inclus: 1) marginea posterioară care atinge discul; 2) creșterea documentată; și 3) grosimea crescută a tumorii (mai mare/echivalentă cu 1,1 mm).13 Studiul observațional cu tumori mici realizat de Collaborative Ocular Melanoma Study (COMS) Group a identificat factori de risc similari asociați cu creșterea tumorii; și anume: 1) grosimea apicală mai mare a tumorii, 2) diametrul bazal inițial mai mare, 3) prezența pigmentului portocaliu, 4) absența drusen-ului și 5) absența modificărilor epiteliale pigmentare retiniene adiacente tumorii.15 Acești ultimi doi factori confirmă observația clinică potrivit căreia prezența drusenului și a modificărilor pigmentare sunt indicatori de cronicitate și, prin urmare, sunt mai susceptibile de a fi observate peste leziunile latente, benigne. 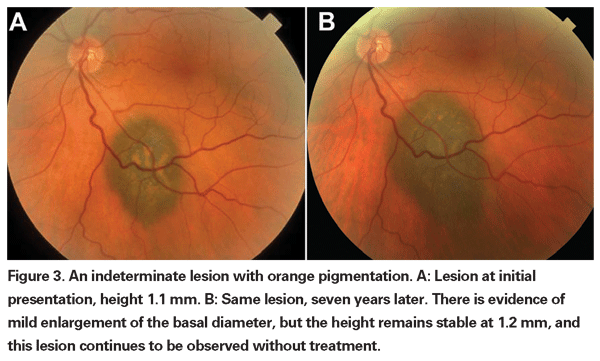
Caracteristicile imagistice pot fi, de asemenea, utile în evaluarea potențialului de malignitate. Prezența unei zone liniștite interne pe ecografia B-scan și a punctelor fierbinți pe angiografia cu fluoresceină s-au dovedit a fi factori de predicție a creșterii tumorale.16 Rolul tomografiei în coerență optică în evaluarea leziunilor coroidiene este, de asemenea, în curs de explorare. Gabriella Espinoza, MD, și colegii săi au propus că OCT poate fi valoroasă în diferențierea între lichidul subretinian activ, în cazul în care retina care acoperă leziunea este ridicată, dar în rest are un aspect normal, și modificările cronice, cum ar fi subțierea retinei sau chisturile intraretiniene. În seria lor mică, aceștia au găsit o corelație între un fluid subretinian activ pe OCT și o creștere tumorală documentată.17
Tratament precoce vs. tratament precoce. Observare
Când enucleația era singura formă acceptată de tratament pentru melanom, se preconiza observarea până la o creștere documentată pentru tumorile mici care nu puteau fi diagnosticate definitiv ca fiind melanoame la prezentarea inițială. Acum, odată cu disponibilitatea și eficacitatea demonstrată a terapiilor de economisire a globului, se pot aduce argumente în favoarea unui tratament mai precoce al acestor leziuni nedeterminate. Datele din studiile COMS arată că mortalitatea legată de melanom variază în funcție de dimensiunea tumorii la momentul tratamentului. Pentru tumorile medii (definite ca tumori cu înălțimea apicală cuprinsă între 2,5 și 10 mm și cu diametrul bazal cel mai mare de până la 16 mm), mortalitatea specifică melanomului a fost de 10 la sută la cinci ani și de 18 la sută la 10 ani.18 Pentru tumorile mari (cele care depășesc criteriile de mărime pentru tumorile medii, fie în ceea ce privește înălțimea apicală, fie în ceea ce privește cel mai mare diametru bazal; sau tumorile peripapilare cu o înălțime apicală mai mare de 8 mm), ratele au crescut la aproximativ 27 la sută la cinci ani și 40 la sută la 10 ani.19 În plus, după cum s-a menționat mai sus, s-a demonstrat că o creștere documentată înainte de tratament este un factor de risc pentru metastaze. Cu toate acestea, creșterea poate fi un marker pentru tumori mai agresive și nu s-a dovedit că tratarea acestor tumori mai devreme reduce mortalitatea.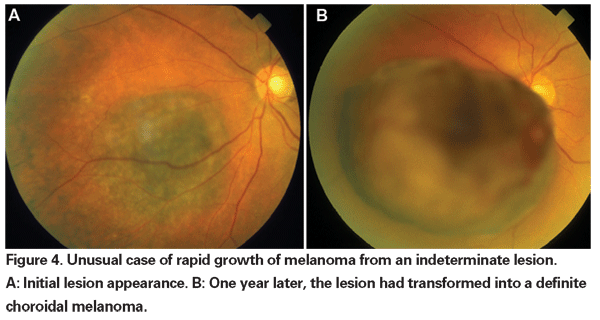
Metodele noastre actuale de radioterapie permit un control local eficient al tumorii cu conservarea globului, dar morbiditatea vizuală este încă ridicată. Prin urmare, este necesar să se pună în balanță riscul de mortalitate generat de o observație atentă înainte de tratamentul leziunilor nedeterminate și consecințele pierderii vizuale induse de terapie. În cadrul studiului observațional COMS privind tumorile mici, au existat șase decese legate de melanom dintr-un grup de 67 de pacienți cu tumori care au fost tratate după o perioadă inițială de observație.20 Doar două dintre aceste decese au survenit în termen de cinci ani de la înscriere, rezultând o rată de mortalitate specifică melanomului de aproximativ 3 la sută la cinci ani. Mai recent, cercetătorii de la Bascom Palmer Eye Institute au raportat o rată de mortalitate specifică melanomului la cinci ani de 3,9 la sută într-un grup mic de pacienți cu melanom coroidal suspectat de melanom coroidal observat pentru creșterea sau dezvoltarea pigmentului portocaliu înainte de tratamentul cu radioterapie în plăci.21 Aceste studii sugerează rate scăzute de mortalitate asociate cu tratamentul întârziat pentru leziuni nedeterminate. În plus, o mică serie retrospectivă nu a arătat nicio creștere a mortalității specifice melanomului între pacienții tratați prompt și cei observați inițial.22 Până în prezent, nu există dovezi care să demonstreze un beneficiu de supraviețuire în urma tratamentului precoce față de cel întârziat al tumorilor mici care nu pot fi diagnosticate definitiv ca fiind melanoame. Prin urmare, nu este clar că sacrificarea vederii la un număr mai mare de pacienți cu leziuni nedeterminate va salva cu siguranță mai multe vieți.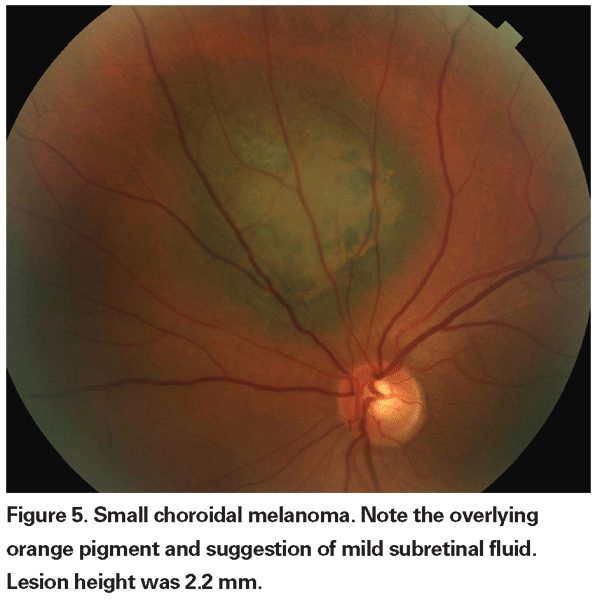
Pentru a rezuma, leziunile pigmentare coroidiene pot fi grupate în trei categorii: 1) leziuni mici, plate, care sunt în mod clar nevi coroidieni; 2) leziuni mici cu elevație <2,5 mm care pot avea pigment portocaliu sau lichid subretinian sau unul dintre ceilalți factori care ridică suspiciunea de malignitate – așa-numitele leziuni nedeterminate; și 3) tumori coroidiene în formă de dom sau ciupercă mai mari/egale cu 2,5 mm care sunt în mod clar melanoame. Tratamentul leziunilor nedeterminate este cel care rămâne încă o zonă de controversă, iar evaluarea și gestionarea acestor leziuni este cel mai bine realizată de către oncologii oculari. Un studiu clinic care să compare tratamentul precoce vs. tratamentul întârziat pentru leziunile nedeterminate ar putea să nu fie fezabil din cauza numărului mare de pacienți și a duratei de urmărire necesare pentru obținerea unor rezultate concludente. Având în vedere progresele continue ale tehnicilor de diagnostic molecular, cea mai bună speranță pentru creșterea supraviețuirii pacienților cu melanom coroidal constă în dezvoltarea unor tratamente eficiente pentru boala metastatică și în căutarea de biomarkeri care ar putea prezice mai precis transformarea malignă.
Dr. Eichhorn-Mulligan este în rezidențiat în oftalmologie la Harvard Medical School. Dr. Kim este profesor asistent în cadrul Departamentului de Oftalmologie al Școlii de Medicină Harvard, Serviciul de Retină, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Nevi coroidieni într-o populație albă – Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Spectrul clinic al nevi coroidieni pe baza vârstei la prezentare în 3.422 de ochi consecutivi. Ophthalmology 2007: Dec 5 .
3. Singh AD, Kalyani P, Topham A. Estimarea riscului de transformare malignă a unui nev choroidal. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Pierderea vederii asociată cu nevi coroidieni. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Studiul clinic al nevi coroidieni. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Studiul câmpului vizual al melanomatelor coroidale benigne. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Acuitatea vizuală la 3.422 de ochi consecutivi cu nevus coroidal. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Histogeneza melanoamelor maligne ale uveei. II. Relația dintre nevi uveali și melanoamele maligne. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Nevi benigni și melanoame maligne ale coroidei. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Absența schimbării neviilor coroidieni de-a lungul a 5 ani la o populație mai în vârstă. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Extinderea unui nevus coroidal documentat histologic. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Histopatologia creșterii documentate în tumorile coroidale melanocitice mici. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Shields JA, Kiratli H, De Potter P, Cater JR. Factori de risc pentru creșterea și metastazarea leziunilor melanocitice coroidiene mici. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combinația de factori clinici predictivi de creștere a tumorilor melanocitice coroidiene mici. Arch Ophthalmol 2000;118:360-364.
15. Grupul colaborativ de studiu al melanomului ocular. Factori predictivi de creștere și tratament al melanomului coroidal mic. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Natural history of indeterminate pigmented choroidal tumors. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Optical coherence tomography in the evaluation of retinal changes associated with suspicious choroidal melanocytic tumors. Am J Ophthalmol 2004;137:90-95.
18. Grupul de studiu colaborativ al melanomului ocular. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twelve-year mortality rates and prognostic factors: Raportul COMS nr. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, The Collaborative Ocular Melanoma Study Group. Studiul Collaborative Ocular Melanoma Study (COMS), studiu randomizat al iradierii pre-enucleare a melanomului coroidal mare: IV. Rezultatele mortalității la zece ani și factorii de prognostic. Raportul COMS nr. 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortalitatea la pacienții cu melanom coroidal mic. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Rezultatele radioterapiei cu plăci de iod 125 după observarea inițială a melanomelor coroidiene mici suspectate. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.