Formella laddningar
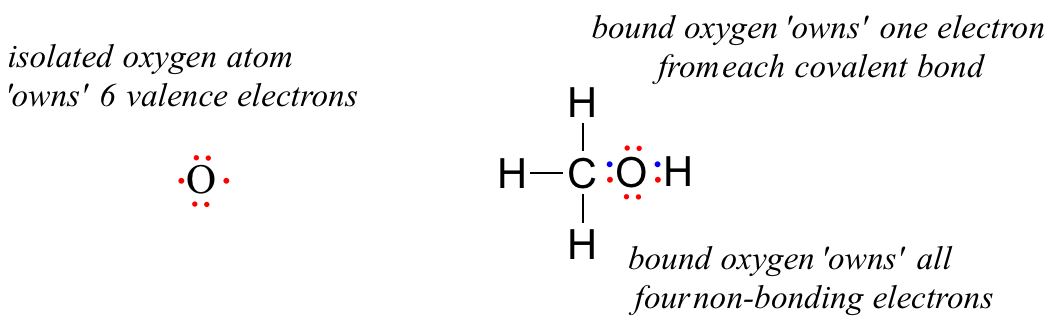
Organiska molekyler kan också ha positiva eller negativa laddningar. Under kemiska reaktioner är det vanligt att reaktant, intermediärer och/eller produkter har laddningar. Att känna igen och skilja mellan neutrala och laddade bindningsmönster kommer att vara till hjälp vid inlärning av reaktionsmekanismer. Tänk på Lewisstrukturen för metanol, CH3OH (metanol är den så kallade ”träalkoholen” som samvetslösa smugglare ibland sålde under förbudstiden på 1920-talet, vilket ofta ledde till att de som drack den blev blinda). Metanol i sig är en neutral molekyl, men kan förlora en proton och bli en molekylär anjon (CH3O-) eller få en proton och bli en molekylär katjon (CH3OH2+).

Den molekylära anjonen och katjonen har en total laddning på -1 respektive +1. Men vi kan vara mer specifika än så – vi kan också för varje molekylär jon ange att en formell laddning är placerad specifikt på syreatomen, snarare än på kol- eller någon av väteatomerna.
Att räkna ut den formella laddningen på olika atomer i en molekyl är en okomplicerad process – det handlar helt enkelt om att addera valenceelektroner.
En obunden syreatom har 6 valenceelektroner. När den är bunden som en del av en metanolmolekyl är en syreatom dock omgiven av 8 valenceelektroner: 4 icke-bindande elektroner (två ”ensamma par”) och 2 elektroner i var och en av dess två kovalenta bindningar (en till kol, en till väte). Enligt den formella laddningskonventionen säger vi att syret ”äger” alla fyra icke-bindande elektroner. Det ”äger” dock bara en elektron från var och en av de två kovalenta bindningarna, eftersom kovalenta bindningar innebär att elektroner delas mellan atomer. Syreatomen i metanol äger därför 2 + 2 + (½ x 4) = 6 valenselektroner.
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
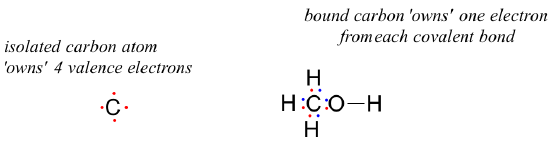
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
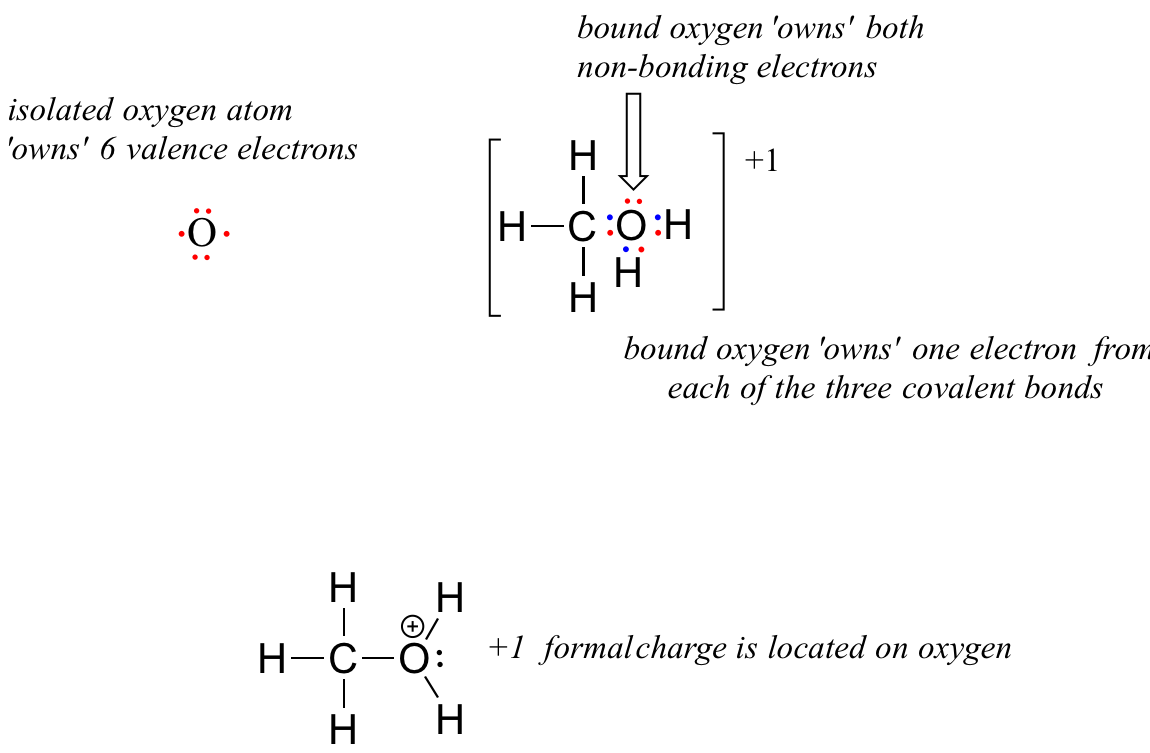
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
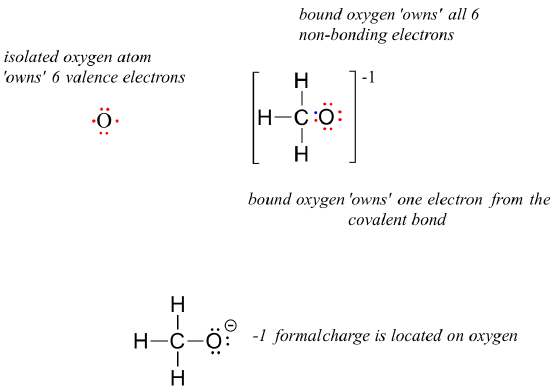
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
När man ritar strukturer för organiska molekyler är det mycket viktigt att visa alla formella laddningar som inte är noll och vara tydlig med var laddningarna är placerade. En struktur som saknar formella laddningar som inte är noll är inte korrekt ritad och kommer förmodligen att markeras som sådan på provet!
När du nu tänker tillbaka på vad du lärt dig i allmän kemi frågar du dig förmodligen: ”Hur är det med dipoler? ”Äger inte syreatomen i en O-H-bindning mer av elektrontätheten än väteatomen på grund av dess större elektronegativitet?” Detta är helt korrekt, och vi kommer att gå igenom begreppet bindningsdipoler senare. När det gäller beräkning av formella laddningar spelar dock bindningsdipoler ingen roll – vi anser alltid att de två elektronerna i en bindning delas lika, även om detta inte är en korrekt återspegling av den kemiska verkligheten. Formella laddningar är just det – en formalitet, en metod för elektronbokföring som är knuten till Lewis-systemet för att rita strukturerna för organiska föreningar och joner. Senare kommer vi att se hur begreppet formell laddning kan hjälpa oss att visualisera hur organiska molekyler reagerar.
För det sista, låt dig inte luras att tro att bara för att nettoladdningen på en struktur är noll finns det inga atomer med formella laddningar: en atom skulle kunna ha en positiv formell laddning och en annan en negativ formell laddning, och nettoladdningen skulle fortfarande vara noll. Zwitterioner, såsom aminosyror, har både positiva och negativa formella laddningar på olika atomer:

Även om nettoladdningen på glycin är noll är det ändå nödvändigt att visa var de positiva och negativa formella laddningarna är placerade.
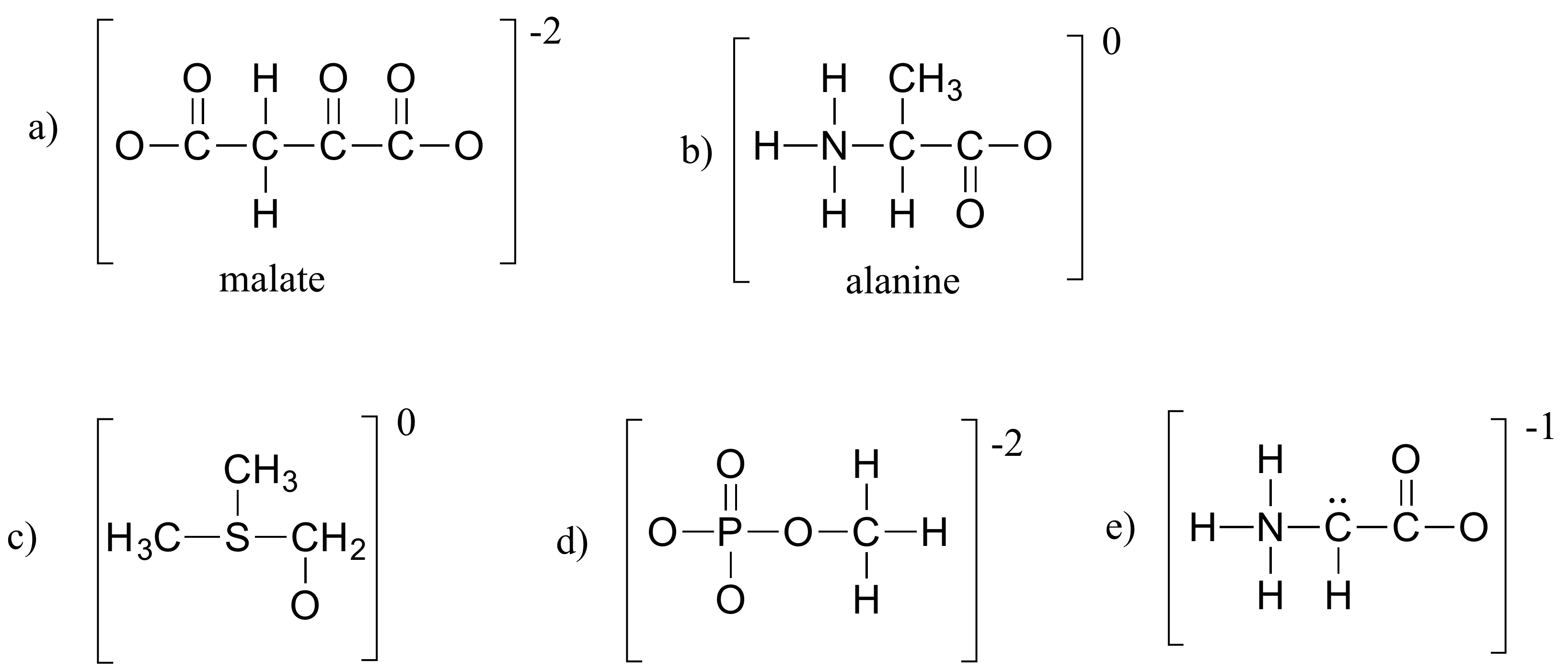
Övningsuppgift 1.4
Fyller in alla saknade ensamstående parelektroner och formella laddningar i strukturerna nedan. Anta att alla atomer har ett fullständigt valensskal med elektroner. Nettoladdningar visas utanför parenteserna.
Lösningar till övningarna