Elektronegativitet och bindningspolaritet
Och även om vi definierade kovalent bindning som elektrondelning delas elektronerna i en kovalent bindning inte alltid lika mycket av de två bundna atomerna. Om inte bindningen förbinder två atomer av samma grundämne, som i H2, kommer det alltid att finnas en atom som drar till sig elektronerna i bindningen starkare än vad den andra atomen gör, som i HCl, som visas i figur \(\PageIndex{1}\). En kovalent bindning som har en jämn fördelning av elektroner (figur \(\PageIndex{1a}\)) kallas en opolär kovalent bindning. En kovalent bindning med ojämnt fördelade elektroner, som i figur \(\PageIndex{1b}\), kallas en polar kovalent bindning.

Fördelningen av elektrontätheten i en polär bindning är ojämn. Den är större runt den atom som drar till sig elektronerna mer än den andra. Elektronerna i H-Cl-bindningen i en vätekloridmolekyl tillbringar till exempel mer tid nära kloratomen än nära väteatomen. Observera att det skuggade området runt Cl i figur \(\PageIndex{1b}\) är mycket större än det är runt H.
Denna obalans i elektrontäthet resulterar i en uppbyggnad av partiell negativ laddning (betecknad som δ-) på ena sidan av bindningen (Cl) och en partiell positiv laddning (betecknad som δ+) på andra sidan av bindningen (H). Detta syns i figur \(\PageIndex{2a}\). Laddningsdelningen i en polär kovalent bindning resulterar i en elektrisk dipol (två poler), som representeras av pilen i figur \(\PageIndex{2b}\). Pilens riktning pekar mot δ-änden medan pilens + svans visar δ+-änden av bindningen.

Figur \(\PageIndex{2}\): (a) Olika fördelning av det bindande elektronparet mellan H och Cl leder till delvis positiv laddning på H-atomen och delvis negativ laddning på Cl-atomen. Symbolerna δ+ och δ- anger polariteten hos H-Cl-bindningen. (b) Dipolen representeras av en pil med ett kryss i svansen. Korset är nära δ+-änden och pilspetsen sammanfaller med δ-.
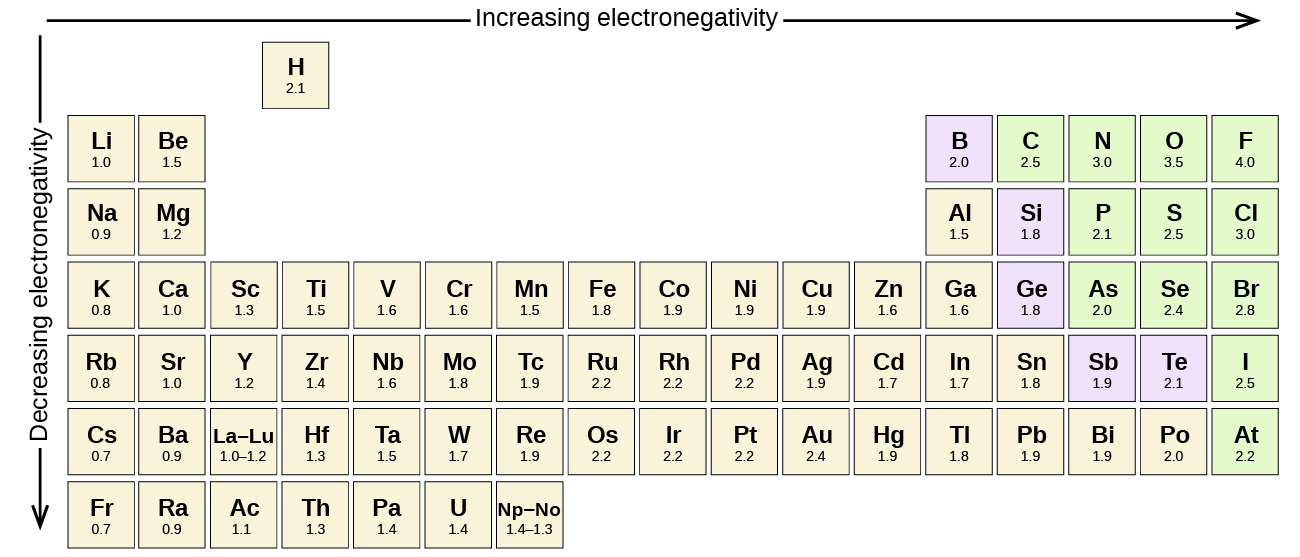
Alla kovalenta bindningar mellan atomer av olika grundämnen är polära bindningar, men graden av polaritet varierar kraftigt. Vissa bindningar mellan olika grundämnen är endast minimalt polära, medan andra är starkt polära. Joniska bindningar kan betraktas som den ultimata polariteten, där elektroner överförs snarare än delas. För att bedöma den relativa polariteten hos en kovalent bindning använder kemister elektronegativitet, som är ett relativt mått på hur starkt en atom drar till sig elektroner när den bildar en kovalent bindning. Det finns olika numeriska skalor för att bedöma elektronegativitet. Figur \(\PageIndex{3}\) visar en av de mest populära – Paulingskalan.
Närmare tittande: Linus Pauling
Linus Pauling (1901-94) är utan tvekan 1900-talets mest inflytelserika kemist och den enda person som har vunnit två individuella (det vill säga odelade) Nobelpris. På 1930-talet använde Pauling nya matematiska teorier för att formulera några grundläggande principer för kemiska bindningar. Hans bok The Nature of the Chemical Bond från 1939 är en av de mest betydelsefulla böcker som någonsin har publicerats inom kemin.
Häromkring 1935 vände sig Paulings intresse till biologiska molekyler, och han tilldelades 1954 Nobelpriset i kemi för sitt arbete med proteinstruktur. (Han var mycket nära att upptäcka DNA:s dubbelspiralstruktur när James Watson och James Crick tillkännagav sin egen upptäckt av dess struktur 1953). Han tilldelades senare Nobels fredspris 1962 för sina insatser för att förbjuda testning av kärnvapen.

Linus Pauling var en av 1900-talets mest inflytelserika kemister.
Under sina senare år blev Pauling övertygad om att stora doser C-vitamin skulle förebygga sjukdomar, inklusive förkylning. De flesta kliniska undersökningar lyckades inte visa något samband, men Pauling fortsatte att ta stora doser dagligen. Han dog 1994 och hade tillbringat ett helt liv med att skapa ett vetenskapligt arv som få någonsin kommer att kunna mäta sig med.
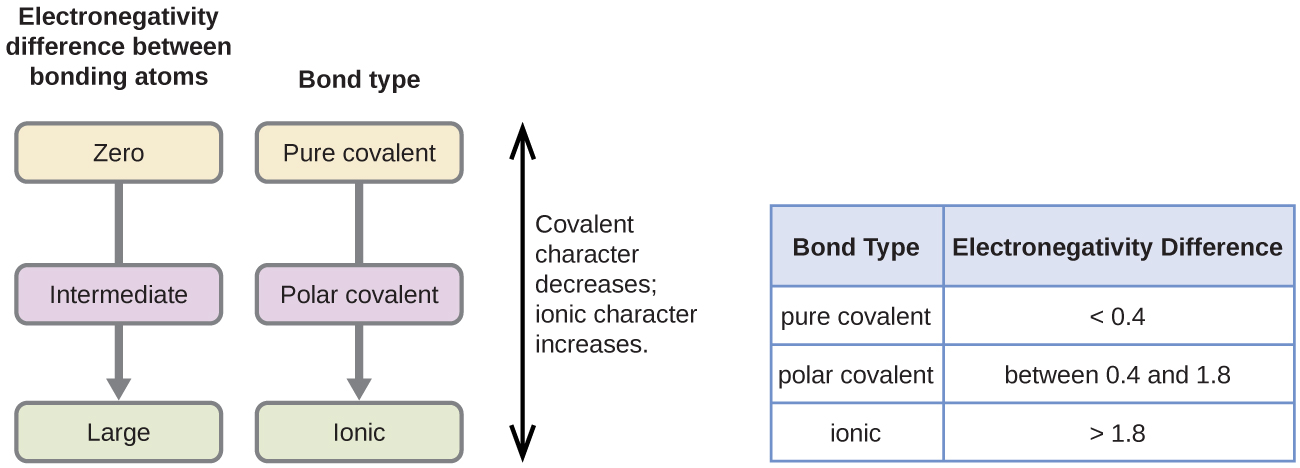
Polarisiteten hos en kovalent bindning kan bedömas genom att bestämma skillnaden i elektronegativiteten hos de två atomer som bildar bindningen. Ju större skillnaden i elektronegativitet är, desto större är obalansen i elektronfördelningen i bindningen. Även om det inte finns några fasta regler är den allmänna regeln att om skillnaden i elektronegativitet är mindre än cirka 0,4 anses bindningen vara opolär; om skillnaden är större än 0,4 anses bindningen vara polär. Om skillnaden i elektronegativitet är tillräckligt stor (i allmänhet större än cirka 1,8) betraktas den resulterande föreningen som jonisk snarare än kovalent. En elektronegativitetsskillnad på noll indikerar naturligtvis en opolär kovalent bindning.
Exempel \(\PageIndex{1}\)
Beskriv elektronegativitetsskillnaden mellan varje atompar och den resulterande polariteten (eller bindningstypen).
- C och H
- H och H
- Na och Cl
- O och H
Lösning
- Kol har en elektronegativitet på 2,5, medan värdet för väte är 2,1. Skillnaden är 0,4, vilket är ganska litet. C-H-bindningen anses därför vara opolär.
- Båda väteatomerna har samma elektronegativitetsvärde – 2,1. Skillnaden är noll, så bindningen är opolär.
- Natrium har en elektronegativitet på 0,9, medan klor har en elektronegativitet på 3,0. Skillnaden är 2,1, vilket är ganska högt, och därför bildar natrium och klor en jonisk förening.
- Med 2,1 för väte och 3,5 för syre är skillnaden i elektronegativitet 1,4. Vi skulle förvänta oss en mycket polär bindning. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.