Introduktion
Ionisk bindning är den fullständiga överföringen av valenselektron(er) mellan atomer. Det är en typ av kemisk bindning som genererar två motsatt laddade joner. I joniska bindningar förlorar metallen elektroner för att bli en positivt laddad katjon, medan icke-metallen tar emot dessa elektroner för att bli en negativt laddad anjon. Joniska bindningar kräver en elektrondonator, ofta en metall, och en elektronacceptor, en ickemetall.
Joniska bindningar observeras eftersom metaller har få elektroner i sina yttersta banor. Genom att förlora dessa elektroner kan dessa metaller uppnå ädelgaskonfiguration och uppfylla oktettregeln. På samma sätt tenderar icke-metaller som har nära 8 elektroner i sina valensskal att lätt ta emot elektroner för att uppnå ädelgaskonfiguration. I joniska bindningar kan mer än en elektron doneras eller tas emot för att uppfylla oktettregeln. Anjonens och katjonens laddningar motsvarar antalet donerade eller mottagna elektroner. I joniska bindningar måste föreningens nettoladdning vara noll.
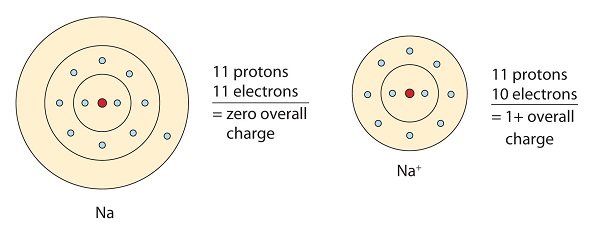
Denna natriummolekyl donerar den ensamma elektronen i sin valensorbital för att uppnå oktettkonfiguration. Detta skapar en positivt laddad katjon på grund av elektronförlusten.
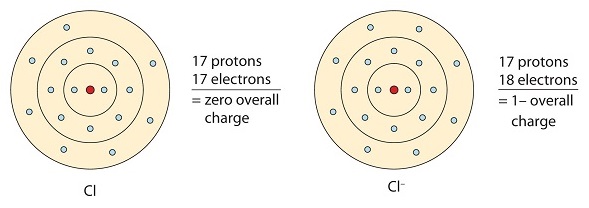
Denna kloratom tar emot en elektron för att uppnå sin oktettkonfiguration, vilket skapar en negativt laddad anjon.
Den förutspådda totala energin för den joniska bindningsprocessen, som inkluderar metallens joniseringsenergi och icke-metallens elektronaffinitet, är vanligtvis positiv, vilket indikerar att reaktionen är endotermisk och ogynnsam. Denna reaktion är dock mycket gynnsam på grund av den elektrostatiska attraktionen mellan partiklarna. Vid det ideala interatomära avståndet frigör attraktionen mellan dessa partiklar tillräckligt med energi för att underlätta reaktionen. De flesta joniska föreningar tenderar att dissociera i polära lösningsmedel eftersom de ofta är polära. Detta fenomen beror på de motsatta laddningarna på varje jon.
Exempel \(\PageIndex{1}\): Klorsalter
.jpg?revision=2)
I det här exemplet donerar natriumatomen sin 1 valenselektron till kloratomen. Detta skapar en natriumkatjon och en kloranjon. Lägg märke till att nettoladdningen i den resulterande föreningen är 0.
.jpg?revision=2)
I det här exemplet donerar magnesiumatomen båda sina valenselektroner till kloratomer. Varje kloratom kan bara ta emot 1 elektron innan den kan uppnå sin ädelgaskonfiguration. Därför krävs det 2 kloratomer för att ta emot de 2 elektroner som magnesiumet har donerat. Notice that the net charge of the compound is 0.