Beräkning av osmältningsgrader (DoU)
Osmältningsgrad (DoU) är också känt som dubbelbindningsekvivalent. Om molekylformeln är angiven, sätt in siffrorna i denna formel:
- \(C\) är antalet kolväten
- \(N\) är antalet kväveämnen
- \(X\) är antalet halogener (F, Cl, Br, I)
- \(H\) är antalet väten
Som tidigare nämnts innehåller en mättad molekyl endast enkla bindningar och inga ringar. Ett annat sätt att tolka detta är att en mättad molekyl har det högsta möjliga antalet väteatomer för att vara en acyklisk alkan. Antalet väteatomer kan alltså representeras av 2C+2, vilket är den allmänna molekylära representationen av en alkan. Som exempel kan nämnas att för molekylformeln C3H4 är antalet faktiska väteatomer som krävs för att föreningen ska vara mättad 8 . Föreningen behöver ytterligare 4 kolväten för att vara helt mättad (förväntat antal kolväten – observerat antal kolväten=8-4=4). Graden av omättnad är lika med 2 eller hälften av det antal kolväten som molekylen behöver för att klassificeras som mättad. Därför dividerar DoB-formeln med 2. Formeln subtraherar antalet X eftersom en halogen (X) ersätter ett väte i en förening. I t.ex. kloretan, C2H5Cl, finns det ett väte mindre jämfört med etan, C2H6.
För att en förening ska vara mättad finns det ett mer väte i en molekyl när kväve är närvarande. Därför lägger vi till antalet kväveämnen (N). Detta kan ses med C3H9N jämfört med C3H8. Syre och svavel ingår inte i formeln eftersom mättnad inte påverkas av dessa element. As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, att graden av omättnad endast ger summan av dubbelbindningar, trippelbindningar och/eller ringar. Exempelvis kan en omättnadsgrad på 3 innehålla 3 ringar, 2 ringar+1 dubbelbindning, 1 ring+2 dubbelbindningar, 1 ring+1 trippelbindning, 1 dubbelbindning+1 trippelbindning eller 3 dubbelbindningar.
Exempel:
Vilken grad av omättnad har bensen?
LÖSNING
Molekylformeln för bensen är C6H6. Således,
DoU= 4, där C=6, N=0,X=0 och H=6. 1 DoB kan motsvara 1 ring eller 1 dubbelbindning. Detta motsvarar bensen som innehåller 1 ring och 3 dubbelbindningar.
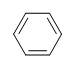
När man ger bensen molekylformeln C6H6 är bensen dock bara en av många möjliga strukturer (isomerer). Följande strukturer har alla en DoB på 4 och har samma molekylformel som bensen.