


Innehållsförteckning
Patofysiologi för PCOS
Diagnostiska kriterier
Insulinresistens och Leptinresistens
Författare
Många av oss inser inte hur väl det intrikata systemet av återkopplingsslingor i vårt reproduktiva endokrina system fungerar förrän det störs på något sätt. Polycystiskt ovariesyndrom (PCOS) utgör ett exempel på detta. Det är en störning som kännetecknas av en samling symtom och är vanligt förekommande hos patienter som kommer till infertilitetskliniker och drabbar 5-10 % av kvinnorna i reproduktiv ålder. Uppskattningsvis 90 % av de anovulatoriska fallen är relaterade till PCOS. Förutom att det påverkar metaboliska parametrar och ägglossning negativt är det också förknippat med flera psykiska problem (t.ex. depression och ångest) hos de kvinnor som har det. I del 1 kommer vi att diskutera patofysiologin bakom PCOS, dess diagnostiska kriterier samt insulin- och leptinresistens. I del 2 kommer vi att ta upp hanteringen av PCOS, psykologiska konsekvenser och klinikerns unika roll när det gäller att stödja patienten med PCOS.
Patofysiologi för PCOS
I ovulatoriska kvinnor, under inflytande av en korrekt fungerande hypotalamus-hypofys-ovarisk (HPO) axel, kännetecknas menstruationscykeln av tillväxt och utveckling av (vanligtvis) en enda follikel som extraheras från den månadens kohort (grupp av folliklar). Som svar på GnRH-stimulering utsöndrar den främre hypofysen två viktiga gonadotropiner: Follikelstimulerande hormon (FSH) och luteiniserande hormon (LH). FSH verkar på äggstocken för att hjälpa till att växa och mogna små folliklar. Den månadens dominerande follikel är den som har fått flest FSH-receptorer. Denna follikel kommer att fortsätta att växa och mogna på bekostnad av de återstående små folliklarna, som sedan återabsorberas av kroppen (men dras fortfarande av från kvinnans totala äggförråd). Tillväxten av den dominerande follikeln genererar östradiolproduktion och förhöjda östrogennivåer signalerar att FSH-produktionen ska upphöra via ett negativt återkopplingssystem, men en hög och ihållande östrogennivå kommer att utlösa en engångsökning av LH som gör att ägglossning inträffar.
I en kvinna med PCOS uttrycker HPO-axeln inte normal funktionalitet. Det pulserande hormonet GnRH är förändrat, vilket leder till ökad LH-aktivitet i hypofysen. Denna ökning av LH ökar stimuleringen av thecacellerna (se figur 1), som producerar androstenedion och testosteron, två androgener, och den resulterande hyperandrogena miljön i äggstocken utesluter normal follikeltillväxt, mognad och ägglossning. Äggstocken består då av många små, antrala folliklar som aldrig blir dominanta. Samlingen av dessa folliklar kan orsaka en ökning av äggstockarnas storlek och generera en något förhöjd basal östrogennivå i serum. Det är fortfarande okänt varför PCOS uppstår och vem det påverkar, men man tror att genetik och miljöfaktorer har ett komplext samspel i dess uppkomst och kliniska manifestationer.
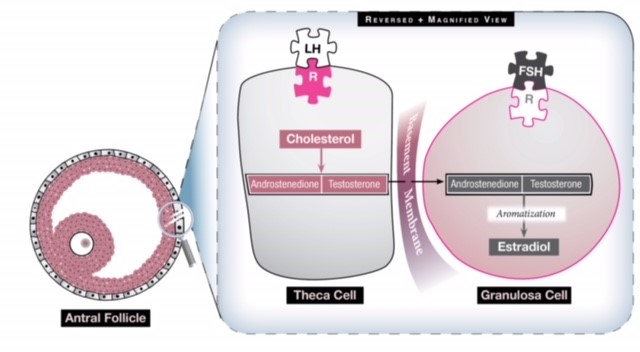
Fig 1: Det finns två celler i äggstocken som bidrar till östrogenproduktionen och de arbetar synergistiskt. Theca-cellen omvandlar kolesterol till två androgener (androstenedion och testosteron) under påverkan av LH. Dessa androgener färdas sedan genom basalmembranet till granulosacellen som under påverkan av FSH omvandlar dem till östrogen via en process som kallas aromatisering. Överdriven LH-stimulering kommer alltså att generera fler androgener än vad som kan omvandlas till östrogen, så östrogennivån blir aldrig tillräckligt hög för att generera en LH-stöt och äggstocken har en hyperandrogen miljö.
Diagnostiska kriterier
PCOS definieras eller diagnostiseras inte av ett enda enkelt symtom och är ofta en uteslutningsdiagnos för kvinnor som har oligo-ovulation och bevis på hyperandrogenism (såsom akne alopeci och hirsutism (manligt mönstrad hårväxt och textur) när andra sjukdomar har uteslutits. Det drabbar kvinnor av alla former, storlekar och bakgrunder. Även om symtomen kan börja vid menarche är de flesta kliniker tveksamma till att diagnostisera en relativt nyligen menstruerande tonåring med PCOS, eftersom oregelbundenhet i menstruationscykeln är normalt under det första året efter menarche och kan försvinna med tiden. De diagnostiska kriterier som används mest idag reviderades vid en internationell expertworkshop i Rotterdam, Nederländerna, 2003 och kallas Rotterdamkriterierna, där följande fastställdes: PCOS kan endast diagnostiseras om patienten har minst två av tre kännetecken: oligo/anovulation, hyperandrogenism (biokemisk eller klinisk) och förekomst av polycystiska äggstockar vid ultraljud.Hyperandrogenism diagnostiseras antingen kliniskt (genom att klinikern observerar androgena symtom) eller biokemiskt (t.ex. förhöjda nivåer av fri testosteron i serum).
Dessa kriterier reviderades 2018 av eninternationell kommitté som gjorde några förändringar. För det första, på grund av tillgången till känsliga transvaginala ultraljudsmaskiner, kännetecknas polycystisk ovariemorfologi (PCOM) av förekomsten av 20 eller fler folliklar (<10 mm) i någon av äggstockarna eller en ovarievolym ≥ 10 mlon någon av äggstockarna som ses med transvaginalt ultraljud, ofta belägen kring äggstockens (eller äggstockarnas) periferi. I 2018 års riktlinjer anges också att om en kvinna har oregelbundna menstruationscykler och hyperandrogenism att ultraljudet inte är nödvändigt för diagnosen, även om många kliniker fortfarande föredrar att utföra detta. Nivåerna av antimulleriskt hormon (AMH) är ofta förhöjda hos PCOS-patienter, även om detta inte är specifikt för PCOS eftersom förhöjda nivåer kan hittas hos kvinnor utan detta tillstånd. Hos kvinnor med PCOS är en förhöjd AMH-nivå ett tecken på ett högre antal folliklar som är fastlåsta i de pre-antrala och antrala stadierna och som inte lyckas få ägglossning.
Andra tillstånd som kan orsaka oregelbundna menstruationscykler (graviditet, hypo- och hypertyreoidism, äggstockssvikt och hyperprolaktinemi) och hyperandrogenism (medfödd binjurehyperplasi, binjurtumör och androgenutsöndrande tumör) måste först uteslutas, Förutom bHCG-nivåer i serum tas därför prover på basala FSH- och LH-nivåer, tyreoideastimulerande hormon (TSH), prolaktin, totalt och fritt testosteron, 17-hydroxyprogesteron (17OHP) och dehydroepiandrosteronsulfat (DHEAS). En av de svåraste differentialdiagnoserna är att skilja en kvinna med funktionell hypotalamisk amenorré (FHA) från en mager kvinna med PCOS. Vanligtvis har kvinnor med FHA ett lågt BMI, men det kan också vara lågt/normalt. Båda tillstånden kännetecknas av anovulation och äggstockar som verkar ha många små folliklar i viloläge. Även om hyperandrogenism inte är en del av FHA kan kvinnor med detta tillstånd ha hirsutism på grund av sin etnicitet, vilket ytterligare förvirrar den kliniska bilden. Ett sätt att skilja FHA frånPCOS är med hjälp av blodprov och ultraljudsundersökningar. Kvinnor med FHA har ofta låga till normala basala FSH- och LH-nivåer (på grund av hypo-stimulering av äggstockarna) och en låg östrogennivå, medan kvinnor med PCOS typiskt sett har förhöjda LH-nivåer i serum och låga till normala FSH-nivåer. Vid ultraljud är livmodern och äggstockarna hos kvinnor med FHA små eller små/normala, medan kvinnor med PCOS vanligtvis har en ökad äggstocksvolym (>10 ml).Det finns ny forskning om ett möjligt samband mellan både FHA och PCOS, eftersom inte alla kvinnor uppvisar karakteristiska drag för något av tillstånden, och FHA och PCOS har en del överlappande drag.
Insulinresistens och leptinresistens
Och även om diagnosen insulinresistens (IR) inte ingår i Rotterdamkriterierna är den mycket vanlig hos kvinnor med PCOS. Ett förhöjt BMI ökar risken för att en kvinna med PCOS har IR, men även icke överviktiga kvinnor med PCOS har mycket större sannolikhet att utveckla insulinresistens än sina storleksmatchade motsvarigheter utan PCOS. Förutom hälsokonsekvenserna av IR (t.ex. metabola syndromet och diabetes mellitus typ 2) förvärrar och bidrar den också till hyperandrogenism i en patientpopulation som redan lider av det.
Den gyllene standarden för att diagnostisera insulinresistens är att använda en hyperinsulinemisk euglykemisk klämma, ett test som måste utföras i en sjukhusmiljö. För de flesta är detta orimligt, så man gör indirekta tester för IR. Hos kvinnor med PCOS som befinner sig i en klinisk situation före graviditet föreslås ett oralt glukostoleranstest (OGTT) med tanke på den höga risken för kvinnor med PCOS att utveckla nedsatt glukostolerans och graviditetsdiabetes under graviditeten. Även om detta test är tidskrävande är det att föredra framför fastande plasmaglukos och insulinnivåer eftersom det kan diagnostisera nedsatt glukostolerans i ett tidigare skede.Hos kvinnor med PCOS som inte tillhör någon högriskkategori (dvs, BMI<25 kg/m2 , inte försöker bli gravid, ingen personlig eller familjehistoria av nedsatt glukostolerans) kan det vara bra att få åtminstone baslinjevärden för fasteglukos, insulin och hemoglobinA1c för att få en ”ögonblicksbild” av patientens glykemiska status.
När en kvinna har PCOS förstärker övervikt eller fetma de metaboliska konsekvenserna. Vita fettceller är metaboliskt aktiva. På en normal nivå är de skyddande eftersom de utgör ett säkert hem för lipider och håller fett borta från organ. När det finns för många fettceller kan de bli överbelastade och brista, vilket frigör fettsyror i blodomloppet som kan påverka alla organ. Dessa fettceller ”fastnar” mellan cellerna i organen och gör dem stela, skadade, mindre funktionella och orsakar kronisk inflammation. Det är inte ovanligt att diagnosen ”fettlever” ställs hos en kvinna med PCOS som är överviktig, eftersom levern är särskilt sårbar. Dessutom kan ett överskott av fetma föreviga befintlig hyperinsulinemi och insulinresistens genom att störa den känsliga balansen mellan cytokiner och hormoner som produceras av fettvävnad (se figur 2), till exempel genom att minska produktionen av cytokiner som ökar insulinkänsligheten och öka produktionen av cytokiner som främjar inflammation och insulinresistens. Överskott av insulin bidrar ytterligare till bukfetma och hyperandrogenism och skapar en ond cirkel hos PCOS-patienter som kan vara svår att övervinna.
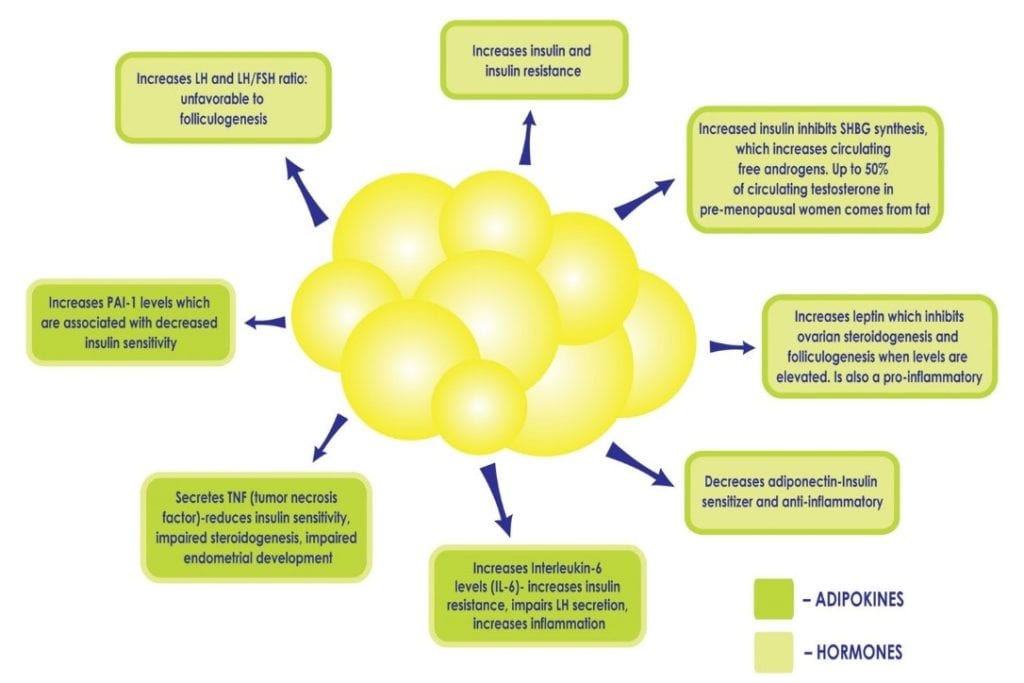
Figur 2: Ökad fetma, och den efterföljande ökningen av fettceller, kan vidmakthålla hyperinsulinemi och insulinresistens genom att störa den känsliga balansen mellan de hormoner som produceras av fettvävnad, t.ex. genom att minska produktionen av adiponektin, en cytokin som ökar insulinkänsligheten och öka andra som främjar inflammation.
Inom insulinresistens kan patienter med PCOS och fetma också lida av vad vissa kallar leptinresistens. Vissa studier har visat att leptinnivåerna är högre hos överviktiga PCOS-patienter jämfört med magra patienter. Leptin är ett protein som produceras av fettvävnad och som reglerar kroppens energibalans och aptit. När det fungerar korrekt signalerar en ökning av leptin att hjärnan ska minska en persons aptit och en minskning av leptin gör det motsatta, det signalerar till hjärnan att öka aptiten för att tillhandahålla det bränsle som behövs för energi. Hos många PCOS-patienter med fetma är dock detta system felaktigt och trots ökade leptinkoncentrationer sekundärt till ökningen av fettvävnad minskar leptins effektivitet, vilket leder till leptinresistens. Leptinresistens anses vara en viktig riskfaktor för patogenesen av övervikt och fetma, eftersom kroppen förblir okänslig för förhöjda nivåer och signalerar till kvinnan att hon fortfarande är hungrig/ej mättad även efter att ha ätit. Många kvinnor med PCOS klagar över att de aldrig känner sig mätta på grund av detta motstånd och fortsätter att äta, vilket leder till en ökning av fettvävnaden, vilket resulterar i ökad leptinresistens och vidmakthåller denna skadliga cykel. Till följd av detta är övervikt och fetma vanliga hos kvinnor med PCOS och viktminskning kan kännas omöjligt eftersom intuitivt ätande inte är effektivt när hunger- och mättnadssignaler är opålitliga.
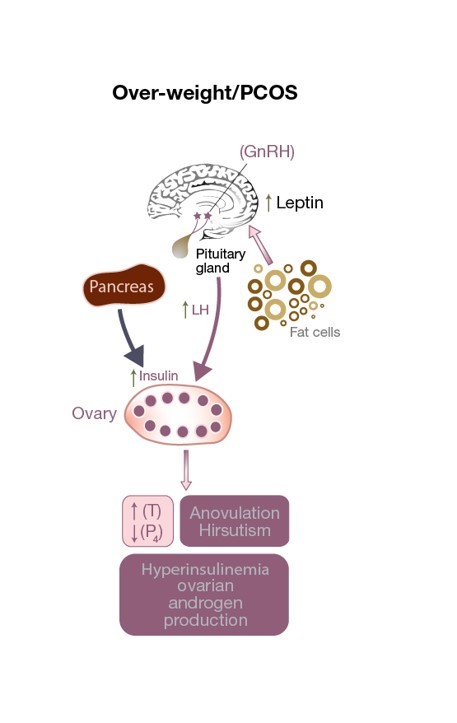
Figur 3: Störning av HPO-axeln hos en PCOS-patient. Det finns en överdriven LH-stimulering på theca-cellen vilket resulterar i en ökning av testosteronnivåerna, en androgen äggstocksmiljö och anovulation (vilket resulterar i låga progesteronnivåer). Ökade leptinnivåer på grund av ett överskott av fettceller påverkar GnRH-sekretionen. Förhöjda insulinnivåer bidrar till hyperandrogenism.
Svårt nedsatt leptinsekretion påverkar inte bara kroppsvikten utan kan ha en skadlig effekt på ägglossning (se figur 3)och även befruktning hos normalviktiga PCOS-patienter. Det förändrar frisättningen av GnRH från hypotalamus, vilket minskar den främre hypofysens stimulering (och därmed också utsöndringen av FSH och LH) och förhindrar utvecklingen av en mogen äggcell. Dessutom lagrar och producerar granulosacellerna också leptin, och höga nivåer av leptin minskar deras aromatiseringsförmåga, vilket i slutändan hindrar en dominant follikel från att producera tillräckliga mängder östrogen (se figur 1). I en liten observationsstudie fann man ett direkt samband mellan koncentrationen av leptin i follikelvätskan (FF-leptin) (som har korrelerats med befruktningsgraden) hos magra kvinnor med PCOS som genomgått IVF jämfört med normalt äggulerande, viktmatchade kvinnor.
Författare
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Särskilt tack till NeilChappell, MD för hans hjälp med redigeringen av denna artikel.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter ”



![]()