As we search for Periodic Table or P Table but we didn’t get the complete information regards periodic table but don’t need to be a worry here you get complete information regarding periodic table and in PDF file which you can easily save on your device and then use it. What we have done by our end that we have to make the list with some important links so by which you get all the information.
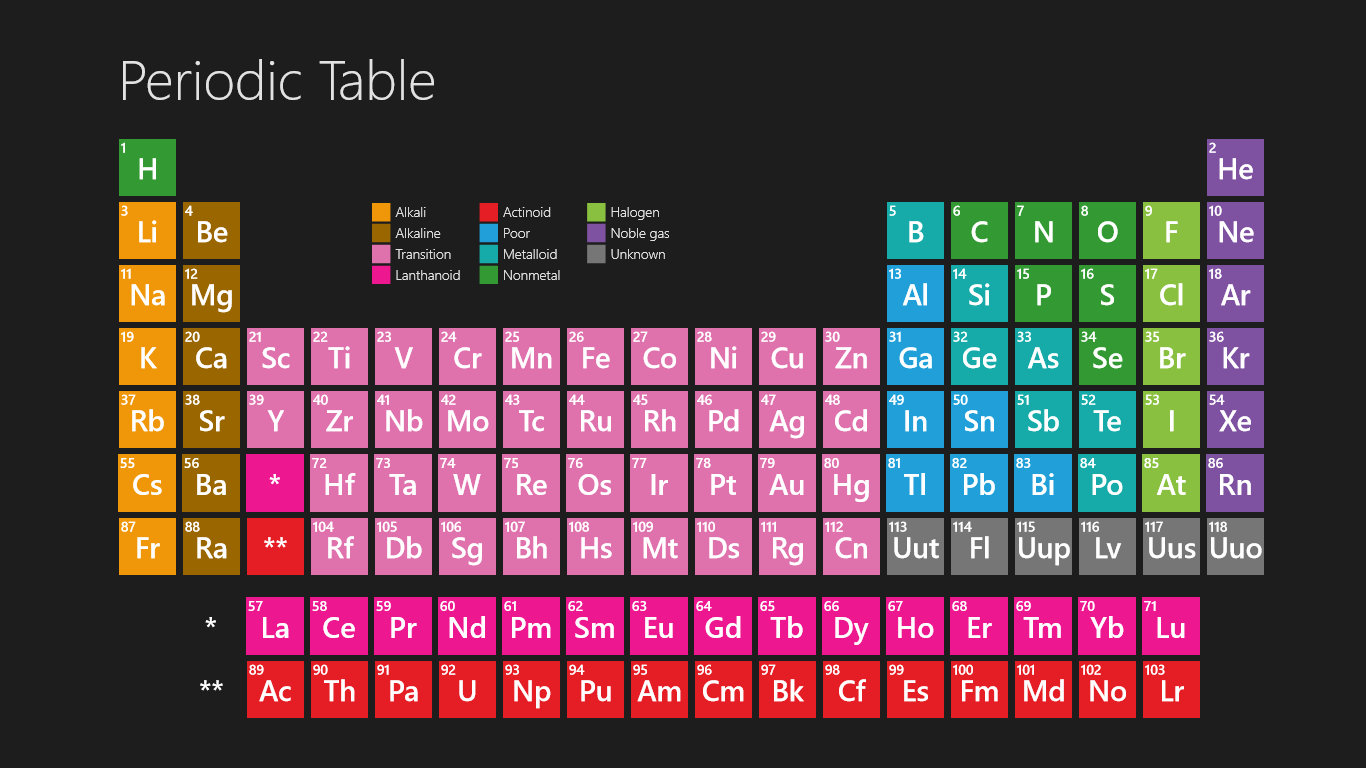

The HD periodic table for kids helps you a lot get clear information and which you can see on your device also. You can use it and fit it on your sheet also, and don’t need to take tension regarding if the paper is lost then what, so friends don’t worry about that because you can also take print as much as you can of this periodic table for your own personal use where you take it for homework problems or performing lab calculations.
- Hydrogen Valence Electrons
- Helium Valence Electrons
- Lithium Valence Electrons
- Beryllium Valence Electrons
- Boron Valence Electrons
- Carbon Valence Electrons
- Nitrogen Valence Electrons
- Oxygen Valence Electrons
- Fluorine Valence Electrons
- Neon Valence Electrons
- Sodium Valence Electrons
- Magnesium Valence Electrons
- Aluminum Valence Electrons
- Silicon Valence Electrons
- Phosphorus Valence Electrons
- Sulfur Valence Electrons
- Chlorine Valence Electrons
- Argon Valence Electrons
- Potassium Valence Electrons
- Calcium Valence Electrons
- Scandium Valence Electrons
- Titanium Valence Electrons
- Vanadium Valence Electrons
- Chromium Valence Electrons
- Manganese Valence Electrons
- Iron Valence Electrons
- Cobalt Valence Electrons
- Nickel Valence Electrons
- Copper Valence Electrons
- Zinc Valence Electrons
- Gallium Valence Electrons
- Germanium Valence Electrons
- Arsenic Valence Electrons
- Selenium Valence Electrons
- Bromine Valence Electrons
- Krypton Valence Electrons
- Rubidium Valence Electrons
- Strontium Valence Electrons
- YttriumValence Electrons
- Zirconium Valence Electrons
- Niobium Valence Electrons
- Molybdenum Valence Electrons
- Technetium Valence Electrons
- Ruthenium Valence Electrons
- Rhodium Valence Electrons
- Palladium Valence Electrons
- Free Printable Periodic Table
- Periódusos rendszer töltésekkel
- Periódusos rendszer atomtöltésekkel
- Elemek periódusos rendszere nevekkel
- Dinamikus periódusos rendszer
- Üres periódusos rendszer
- Elemek periódusos táblázata nyomtatható
- IUPAC értékek
- Nyomtatható táblázat tendenciák
- Periódusos rendszer trendek diagram
- Periódustáblázat 2021
- Nyomtatható táblázat háttérkép
- Nyomtatható periódusos rendszer atomi tömeggel
- Periódusos rendszer elektronegativitással
- Fekete-fehér periódusos rendszer
- Interaktív periódusos rendszer
- Interaktív periódusos rendszer gyerekeknek
- Ingyenes periódusos táblázat PDF
- Periódusos rendszer tömeggel
- Periódusos rendszer orbitálisai
- S, P, D, F orbitálisok periódusos rendszer
Free Printable Periodic Table
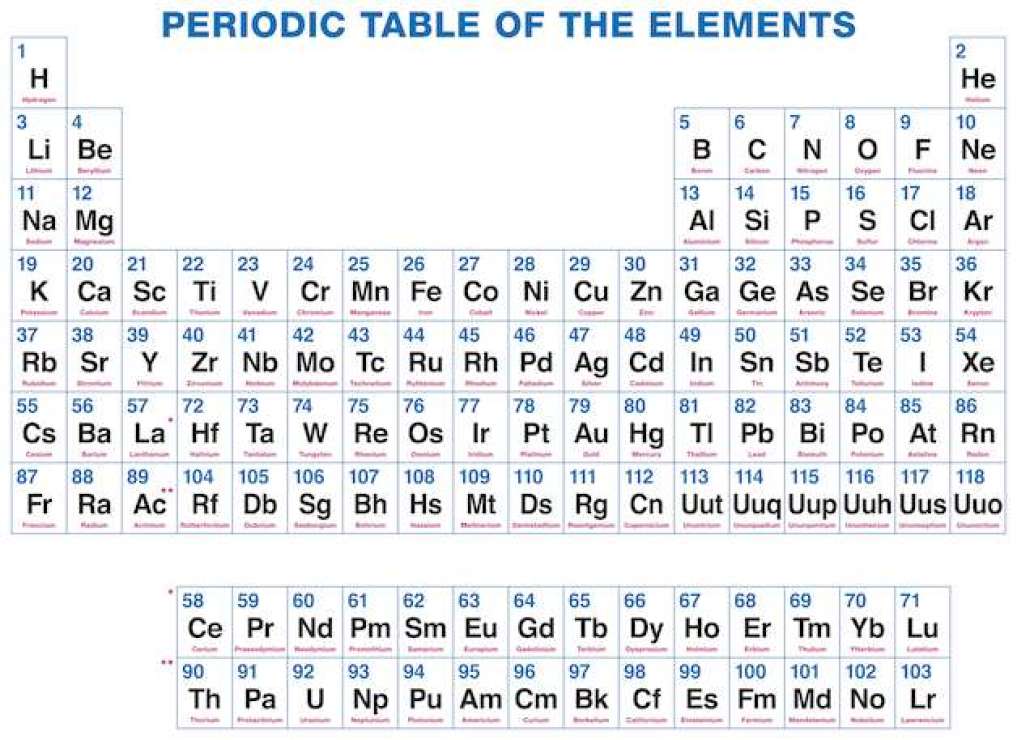
As we all know there are 118 elements in the periodic table and this periodic table cites the keeping with most IUPAC values and by this, you can use it for your calculation and homework.
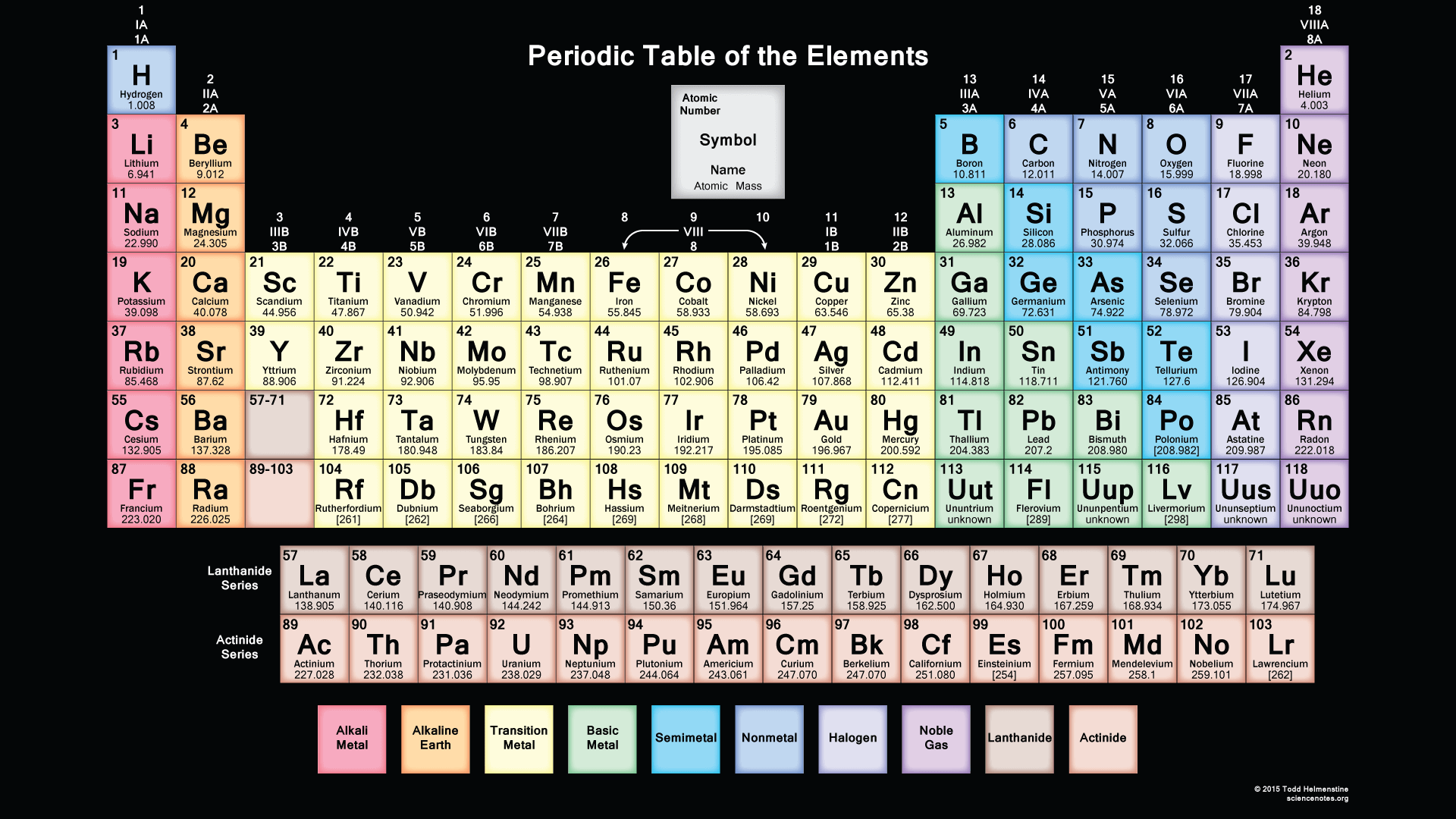

You can also print any interactive periodic table by your end which helps you to know more about this, there are some elements which are fundamentally different from the conventional periodic table and which is defined by charge positive or negative and valence statements were taken by these elements and these are the few things which make the periodic table much more effective.
Ezért rengeteg könyv is van a periódusos rendszerről, és minden könyv ugyanazt az információt adja különböző módon, és ezt nem hanyagolhatjuk el, mert minden könyvből tanulunk valami újat.
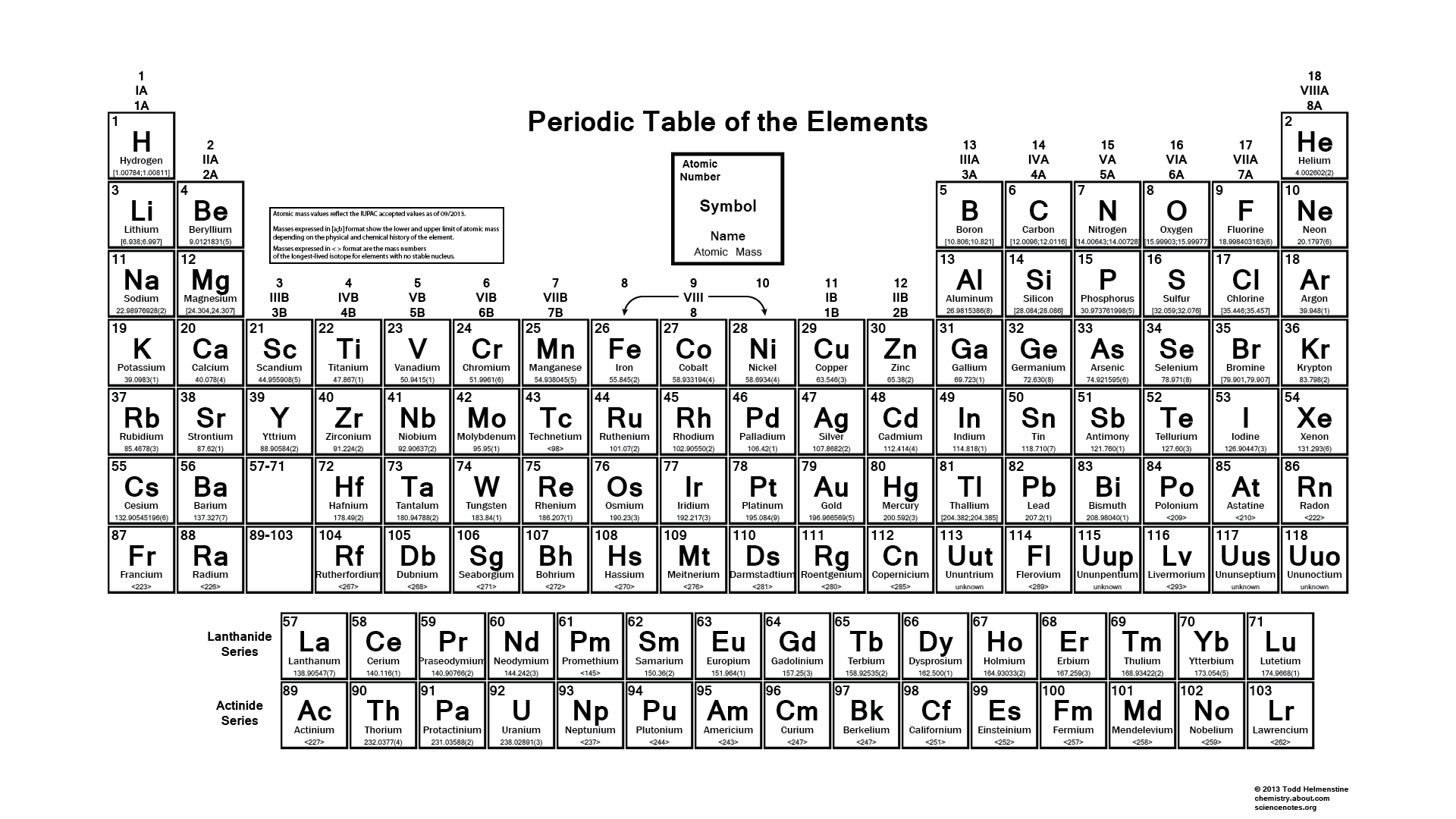

Ezek mellett látunk egy alaptáblázatot is, amelyet a diákok a saját végükön is kitölthetnek, amit üres periódusos rendszernek nevezünk. A tanuló kitöltheti, és ez a periódusos rendszer segít nekik a tanulás javításában.
Periódusos rendszer töltésekkel
Mindannyian tudjuk, hogy a periódusos rendszer értéke a kémiai elemek atomjainak töltései alapján készült. Ezt a periódusos táblázatot is használhatja, hogy többet tudjon az elemek töltéseiről, és azt is tudja, hogy az elemek hogyan kötődnek más elemekkel. Mint mindannyian tudjuk, az atomok töltései a valenciaelektronon vagy az oxidációs állapoton alapulnak. Az elemek atomja stabil, ha a legkülső cellája teljesen tele van külső elektronokkal vagy félig tele van. És azok, amelyeknek több elektronjuk van, stabil atomnak számítanak.
A periódusos rendszerben a hidrogén áll a csúcson, és 1 protonból és 1 párosítatlan elektronból áll, amelyet szabad gyöknek tekintünk, és ez a párosítatlan elektron alig várja, hogy párt alkosson más elektronokkal.
Periódusos rendszer atomtöltésekkel
Amikor meghalljuk a proton szót, könnyen feltételezzük, hogy pozitívat jelent, és ez azt is jelenti, hogy a hidrogén pozitív ionjait protonként ismerjük. A proton a hidrogén egyik formája, amely az ATP enzimet termeli.
A hidrid az a hidrogén, amelyiknek extra elektronja van, így negatív töltésű iont vagy aniont vesz fel, azaz mínusz előjelet vesz fel, és szabályos hidrogénatomot alkot.
A molekuláris hidrogén az a forma, amikor két hidrogénatom kötést létesít egymással és hidrogénmolekulákat. A H2 szintén molekuláris hidrogén. És két protonból és két elektronból áll, és ez a hidrogén leggyakoribb formája, mert semleges töltéssel stabil, és a hidrogénben gazdag vízben antioxidáns is, és a molekuláris hidrogén a világegyetem legkisebb molekulája, vagyis ahová senki sem mehet, oda ez a molekula könnyen eljuthat.
Itt letöltheted az elemek periódusos rendszerét is töltésekkel.
Elemek periódusos rendszere nevekkel
Most megadom neked az összes periódusos rendszer elemet nevekkel, növekvő atomszámmal. Mint tudjátok, minden elem egy vagy két betűs szimbólumból áll, ami a jelenlegi és a régi nevek egyfajta formája. Az elem száma az atomszám, ami a protonok számát jelenti az atomokban. o – Oxigén
9 – F – Fluor
10 – Do – Neon
11 – Na – Nátrium
12 – Mg – Magnézium
13 – Al – Alumínium
14 – Si – Szilícium
15 – P – Szilícium
15 – Szilícium
15 – P – Szilícium foszfor
16 – S – kén
17 – Cl – klór
18 – Ar – argon
19 – K – kálium
20 – Ca – kalcium
21 – SC – technécium
22 – Ti – kálium
17 – C – klór
18 – Ar – argon Titán
23 – 5 – Vanádium
24 – Cr – Króm
25 – MN – Mangán
26 – Fe – Vas
27 – Co – Kobalt
28 – Ni – Nikkel
29 – Cu – Réz
30 – Zn – Cink
31 – GA – Gallium
32 – Ge – Germánium
33 – As – Arzén
34 – Se – Szelén
35 – br – Arzén
36 – K – Kripton
37 – RB – Kriptonium Rubídium
38 – Sr – Stroncium
39 – Y – ittrium
40 – Zr – cirkónium
41 – Nb – bizmut
42 – Mo – molibdén
43 – TC – technécium
44 – RU – molibdén
43 – Zr – cirkónium
41 – Nb – bizmut
42 – Mo – molibdén
43 – TC – technécium
44 – RU – molibdén ruthénium
45 – Rh – Rodosz
46 – Pd – palládium
47 – Ag – ezüst
48 – Cd – kadmium
49 – IN – India
50 – Sn – ón
51 – Sb – antimon
52 – Te – Tellurium
53 – 1 – Jód
54 – Xe – Xenon
55 – CS – Cézium
56 – Ba – Bárium
57 – La – Lantán
58 – Ce – Cérium
59 – Co- Kobalt
60 – Nd – neodímium
61 – PM – promécium
62 – Sm – szamárium
63- Eu – europium
64 – Gd – gadolínium
65 – Tb – terbium
66 – Dy – diszprózium
67 – Ho – holmium
68 – Er – erbium
69 – Tm – túlium
70 – Yb – itterbium
71 – Lu – lutetium
72 – Hf – hafnium
73 – Ta – ozmium
74 – W – volfrám
75 – Re – rénium
76 – OS – ozmium
77 – Ir – irídium
78 – Pt – platina
79 – Au – arany
80 – HG – higany
81 – Tl – tallium
82 – Pb – ólom
83. Bi – Bismuth
84 – Po – Bismuth
85 – But – Astatine
86 – R – Radon
87 – FR – France
88 – Ra – Radium
90 – Th – Thorium
91 – PA – Protactinium
92 – U – Uranium to
93 – NP – Neptune
94 – pu – Plutónium
95 – Am – America
96 – Cm – Americium
97 – Bk – Berkelium
98 – CF – Kaliforniyum
99 – are – Einstein
100 – FM – Barium
101 – MD – Mendélévium
102 – No – Nobelium
103 – Lt. – Lawrence
104 – R – rutherfordium
105 – DB – Dubnium
106 – SG – Dubnium
107 – Hs – Bohrium
108 – Hs – Hass
109 – Mt – Meitnerium
110 – D – Darmstadtium
111 – RG – rubídium
112 – Cn – Kopernikusz
113 – NH – Némium
111 – RG – rubídium
112 – Cn – Kopernikusz
113 – NH – Meitnerium. Nihon
114 – Fl – Flerov
115 – Mc – Moscow
116 – LV – Livermorium
117 – TS – Tennessee
118 – og – Oganesson
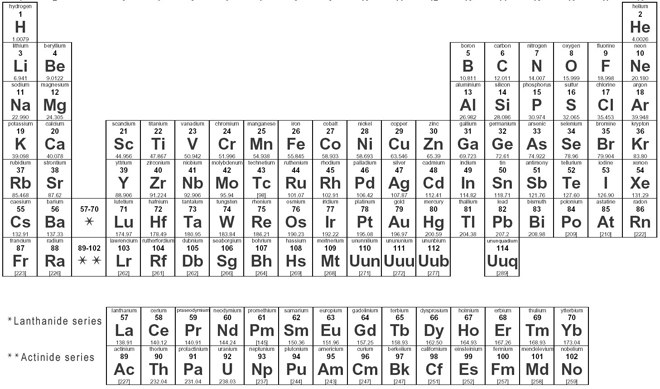

Dinamikus periódusos rendszer
Dinamikus periódusos rendszerrel, minden információt megkapsz a periódusos rendszerről, és itt könnyen lefedhetsz minden egyes elemre vonatkozó információt, beleértve mindent, mint például az elektronok, protonok, neutronok, elektronok a legkülső pályákon, hőmérséklet stb. és itt megjelenítheti a periódusos rendszer adatait, és itt könnyen megismerheti minden egyes elemet, amely a periódusos rendszerben szerepel, és azt kell javasolnom, hogy nézze át, mert itt elmondom az összes atomot, amelyik pozitív, amelyik negatív és amelyik semleges, néhány kép segítségével megkapja az összes információt, a dinamikus periódusos rendszer azt jelenti, hogy minden információt képekkel kap, és ez a kémiai elemek táblázatos elrendezése, és amelyik az atomszámuk szerint van elrendezve.
A hidrogéntől az ógánig minden elemet felfedeztek vagy szintetizáltak. Az első 94 elem természetes elem, a többi elemet laboratóriumokban vagy atomreaktorban tesztelték.
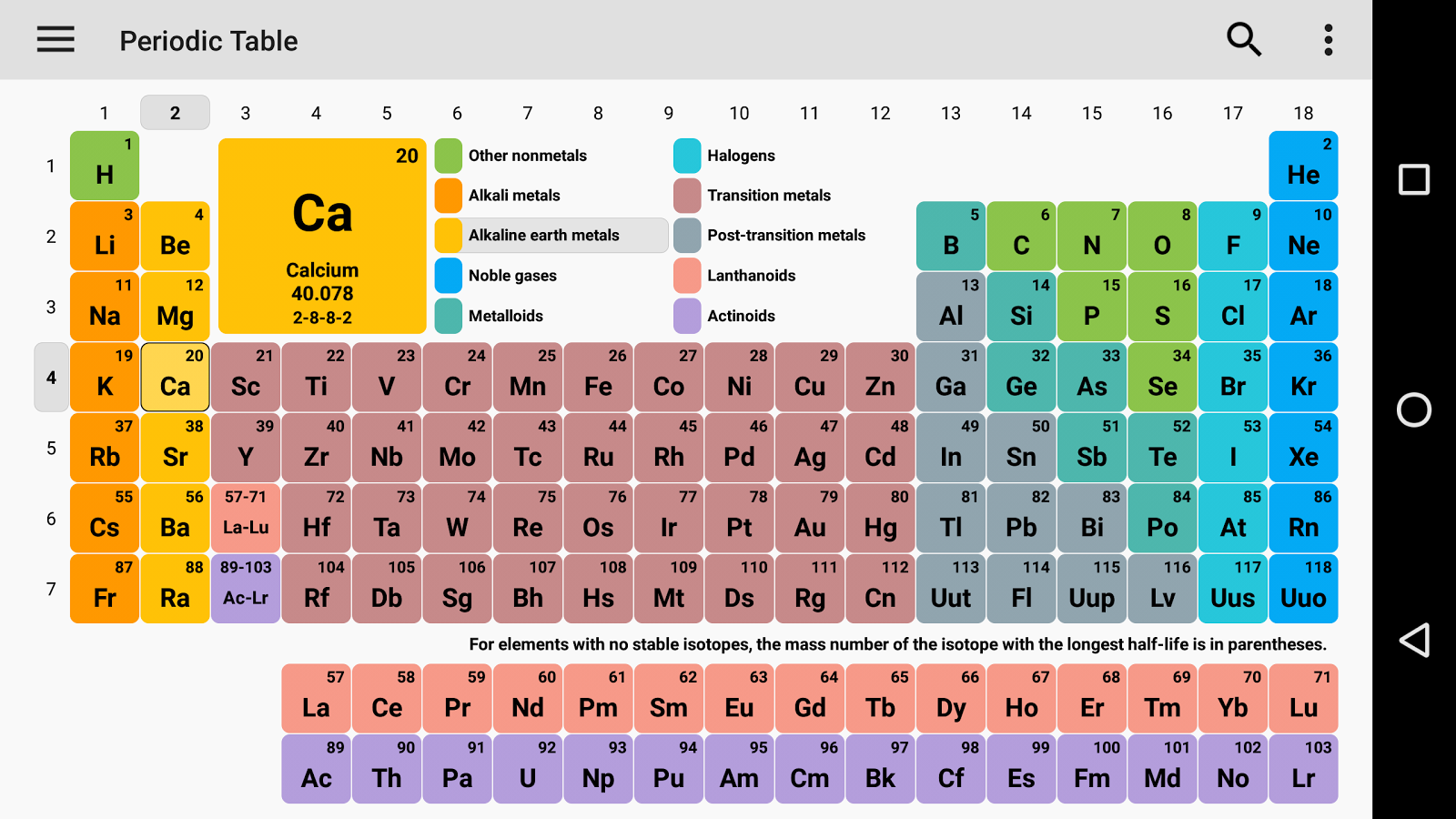

A periódusos rendszerben is történtek változások, és 4 új elemet vettek fel: Nihónium, Moszkovium, Tennessee és Oganesson. Ezt a (IUPAC) 2015. december 30-án erősítette meg, és hivatalosan 2016. november 28-án nevezték el. És az atomi szám nemrég hozzáadott 113,115,117 és 118. És ez a módszer megpróbálja lefedni az összes módszert az iskolától az ipari szakértőig. Így megpróbálhatom mindenkinek elmondani a periódusos rendszerről.
Üres periódusos rendszer
Egy másik periódusos rendszerrel összehasonlítva az Üres periódusos rendszer a legjobb, mert ha látom ebben kitöltjük a periódusos rendszert a végén és a tanuláshoz használhatja ezt, ha mindent tud a periódusos rendszerről, majd kitölti az összes oszlopot és könnyen teszteli a tudását, akkor is használhatja ezt a periódusos rendszer gyakorlatához és használhatja ezt a tankönyvében is.
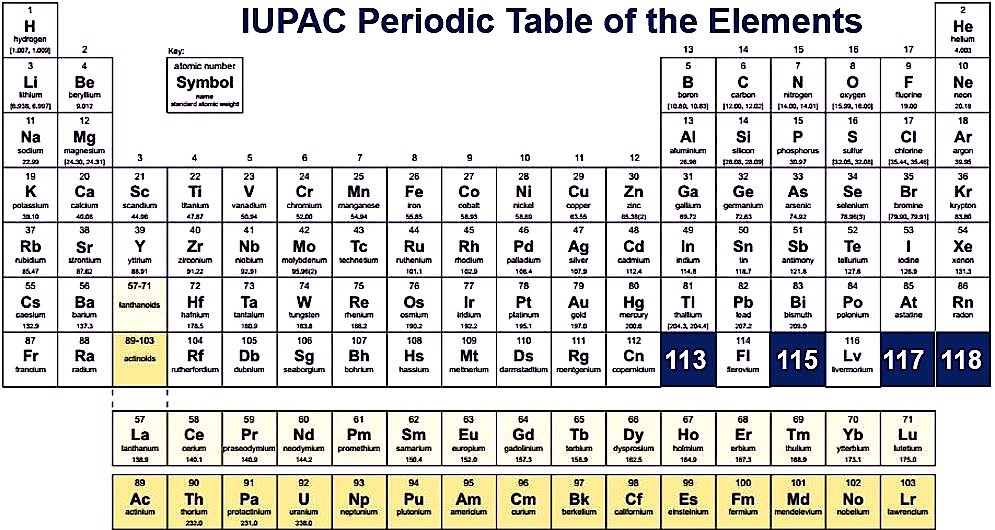

Ezért csak le kell töltened a periódusos rendszer PDF-et egy eszközre, és használhatod azt is, hogy A4-es papírlapra nyomtasd ki. És ebben az üres oszlopban, akkor töltse ki az összes atomi szám, időszakok, és a csoport, ha szükséges. Ön is töltse ki a választható színt egy másik oszlopban, mint az alkálifémek, tranzakciós fémek, lantanidák, aktinidák, metalloidok, halogének és nemesgázok. És a legjobb része az, ha valami hiba, akkor könnyen javíthatja ezt a hibát, mert ott is van esélye, hogy ezt tegye, és ahogy már mondtam, akkor is annyi, mint egy oldal üres nyomtatható periodikus, ezzel a diák is felkészülhet a tesztre, és tesztelni tudásukat.
Itt letöltheti az üres periódusos táblázatot
Elemek periódusos táblázata nyomtatható
Itt könnyen megtalálhatja a tökéletes nyomtatható táblázatot az Ön igényeihez, itt megkaphatja az összes teljes gyűjteményt egy ingyenes nyomtatható periódusos táblázat PDF fájlban vagy PNG képekben, hogy mentse, nyomtassa és használja. Igyekszünk, hogy tegye a teljes információt a periódusos rendszer, és mi is tegye az összes HD képek, ahol, amely akkor tegye, mint egy képernyővédő az eszközökön.
Elfér, ahogyan az eszközén, és könnyen fir az eszközén, és amikor kinyomtatja, akkor is elfér, ahogyan a papírlapon, és a nyomtatással is használhatja személyes használatra, mint például ezt az oldalt laboratóriumi számításokhoz, ez a táblázat átméretezett, így megtekintheti vagy kinyomtathatja bármilyen méretben a kicsiktől a nagy poszter méretig, az Ön választása szerint. Ebben könnyen megkaphatja mind a 118 elemet tényben és számokban. Ebben a nyomtatható periódusos rendszerben az atomi tömegek és a szignifikáns számok, és tartása, hogy a legfrissebb IUPAC értékek.
IUPAC értékek
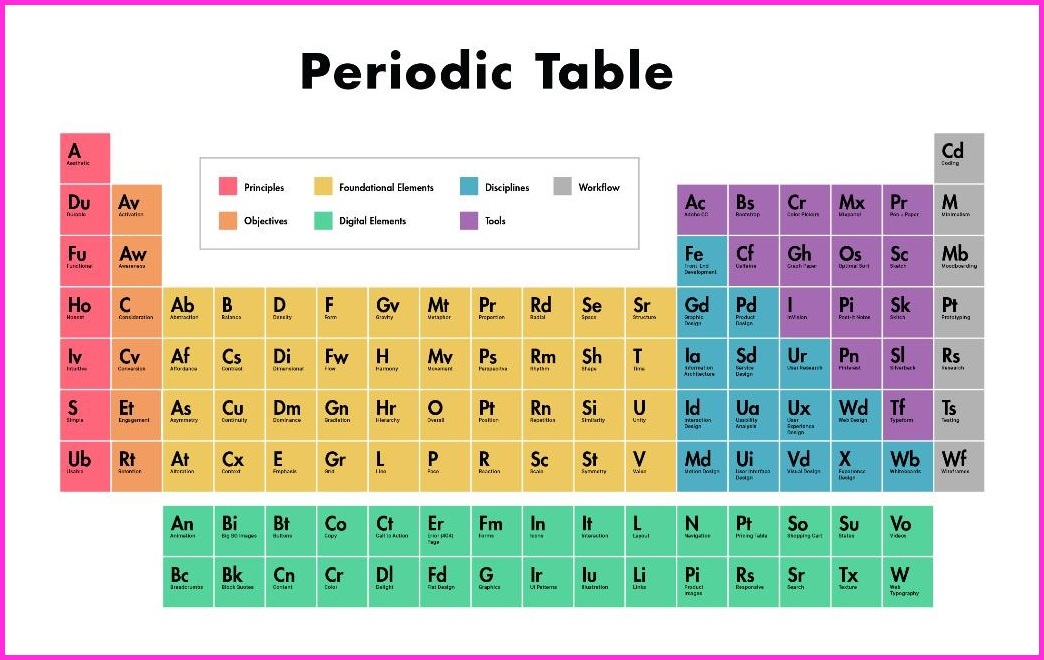

Mint már mondtam, használhatod személyes tesztelésre, és ezzel könnyen tesztelheted a saját tudásodat, és ebben nincsenek határok, kinyomtathatja, amennyit csak tud, és a legjobb része az, hogy számos kép van, amely HD-ben van, és ezt is háttérképet készíthet az eszközén, például mobiltelefonon, laptopon, lapon és sok más dologban, és ezzel mindig emlékszik ezekre a dolgokra.
Az emlékezéshez ezekhez a dolgokhoz könyveket is olvashatsz, amennyire csak tudsz, mert ezzel csak az atomszámról, az atomtömegről és sok más dologról tudsz, de a könyvek olvasása után azt is tudhatod, hogyan használhatod ezt a gyakorlatot, mert ahogy mindannyian tudjuk, a tudomány csak a bizonyítéktól függ, soha nem függnek más dolgoktól, így az én javaslatom nagyon egyszerűen annyi erőfeszítést tesz, amennyit csak tudsz, amivel javíthatod a tanulást, és eredményt is kaphatsz a tanulásra vonatkozóan.
Ha további részleteket kereshetsz, menj ide:
Nyomtatható táblázat tendenciák
Azt a táblázatot használhatja, hogy láthassa a szépség a periódusos rendszer tendenciák elektronegativitás, ionizációs energia, atomsugár, fémes karakter és elektron affinitás. Ezek az elemek szerkezetileg fenyő a periódusos rendszerben. ha beszélek elektronegativitás azt mutatja, hogy milyen könnyen kémiai alkotnak kémiai kötést, és mint látjuk, ez egy növekedés balról jobbra és csökkenés egy jobbról balra egy csoportban. Észrevettük, hogy a nemesgázok (az az oszlop, amelyik a jobb oldalon van) viszonylag inertek, tehát az elektronegativitás közelít a nullához (nem vehetjük általános trendnek).
Amelyik atomnak nagy különbség van az elektronegativitás értékei között, több atom képes kötést kialakítani, amit kémiai kötésnek nevezünk.
Periódusos rendszer trendek diagram
Itt végigmehetünk a periódusos rendszer trendjein
Az ionizációs energiát a legkisebb energiamennyiségnek tekintik, és segíteni kell egy elektron eltávolodását egy atomtól gáz halmazállapotban. Ez növeli az ionizációs energiát, és amikor balról jobbra halad, mert növeli a protonok számát erősebben, és ez tényleg nehéz eltávolítani, hogy.
A nukleáris sweep az elválasztás a magtól a perifériás stabil elektron, míg az ionos tartomány egy nagy része az elválasztás két nukleáris mag között, amelyek egyszerűen érintik egymást. Ez a kapcsolódó becslés hasonló mintázatot mutat az alkalmi táblázatban.
Periódustáblázat 2021
Amint lejjebb haladunk az alkalmi táblázatban, az összetevőknek több protonjuk van, és felvesznek egy elektron életerőhéjat, így az ioták észrevehetően nagyobbak lesznek. Ahogy haladunk az időszakos táblázat egy oszlopán, valamivel több proton és elektron van benne, mégis az elektronokat annál szorosabban tartják a maghoz, így a jota általános mérete csökken.

A periódusos rendszerben sok elem fém, ez azt jelenti, hogy fémes jelleget mutatnak. A fémek összes tulajdonsága, mint a fémes csillogás, nagy elektromos és hővezető képesség, képlékenység, alakíthatóság és számos más tulajdonság. A periódusos rendszer jobb oldala tartalmazza a nemfémeket, amelyek nem mutatják mindezeket a tulajdonságokat. Mint sok más tulajdonság, a fémes jelleg, amely a valenciaelektronok konfigurációjával függ össze.
A szakaszos rendszerben szereplő összetevők túlnyomó többsége fém, ami azt jelenti, hogy fémes jelleget mutatnak. A fémek tulajdonságai magukban foglalják a fémes fényességet, a nagy elektromos és meleg vezetőképességet, a hajlékonyságot, a rugalmasságot és néhány más tulajdonságot. Az alkalmi táblázat jobb oldala tartalmazza a nemfémeket, amelyek nem mutatják ezeket a tulajdonságokat. Hasonlóképpen, a váltakozó tulajdonságokkal a fémes jelleg a valenciaelektronok elrendezésével azonosul.
Nyomtatható táblázat háttérkép
Itt rengeteg nyomtatható háttérképet kapsz, és amelyben teljes információt kapsz a periódusos rendszerről, mint más módon, ebben is megtudhatod az elem nevét, az elemcsaládot, az atomszámot, az atomsúlyt, az elem szimbólumát, a csoportot és az atomtömeget. Ebben a képben, látod az összes információt, és úgy tűnik, nagyon könnyű kép, így nem szembesül semmilyen probléma, hogy látni, és ez is átméretezi tisztán más felbontások. Ez a háttérkép a periódusos rendszer friss frissítése eredeti táblázat szerepelt ezen az oldalon.
Ezzel is kap néhány átlátszó háttérkép HD minőségben, ezzel nem kell szembenézni bármilyen probléma; könnyen látod képek nélkül nyomás vagy hatás a szemét, És ez a kép is le lehet tölteni, és hogy ez a háttérkép. És ez tényleg segít, hogy a jegyzetek és projektek.

És a képek, akkor is látni sok minőségű, mint a fekete-fehér szín, több színű periódusos rendszer, periódusos rendszer az összes elem, kör csempe periódusos rendszer és sok más fajta képek.
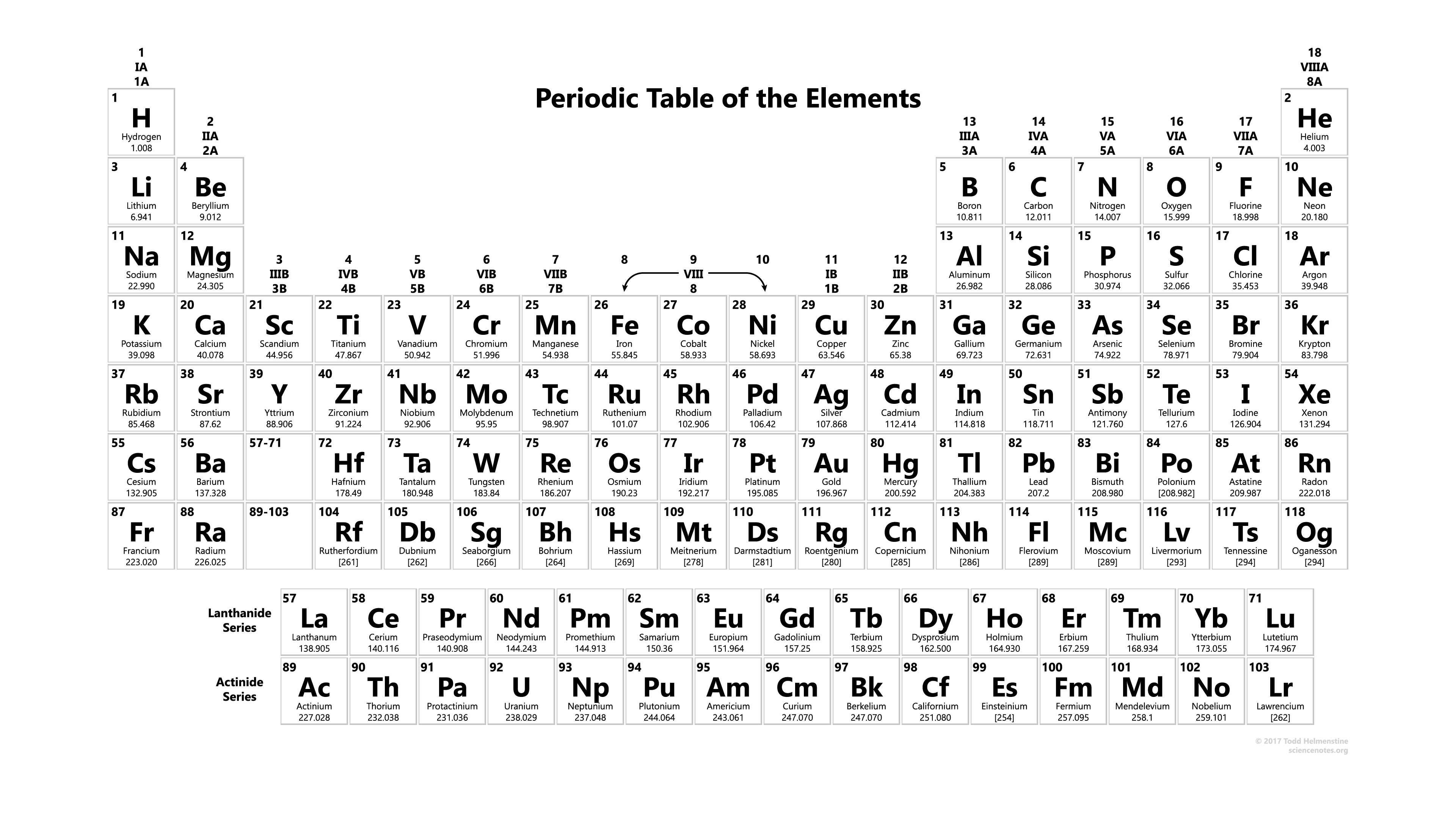
Nyomtatható periódusos rendszer atomi tömeggel
Ezekben teljes információt kap az összes elem atomi tömegéről, amelyet akkor használhat, amikor tanulmányokat végez, vagy amikor laboratóriumi kísérleteket végez, és ezt is használhatja, vagy kinyomtathatja használatra. Az elemek atomtömegéről is kaphatsz információt, és ebben további információkat is megtudhatsz kémiai tulajdonságokról, környezeti adatokról vagy egészségügyi hatásokról, és ez a lista körülbelül 118 kémiai elemet tartalmaz, és ezzel minden elem atomtömegét megismerheted.

Letöltés innen: Periódusos rendszer atomtömeggel
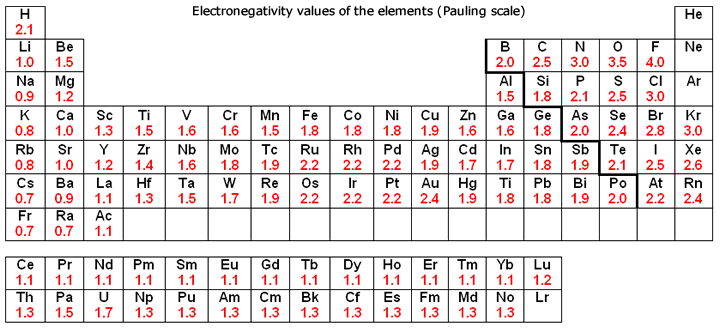
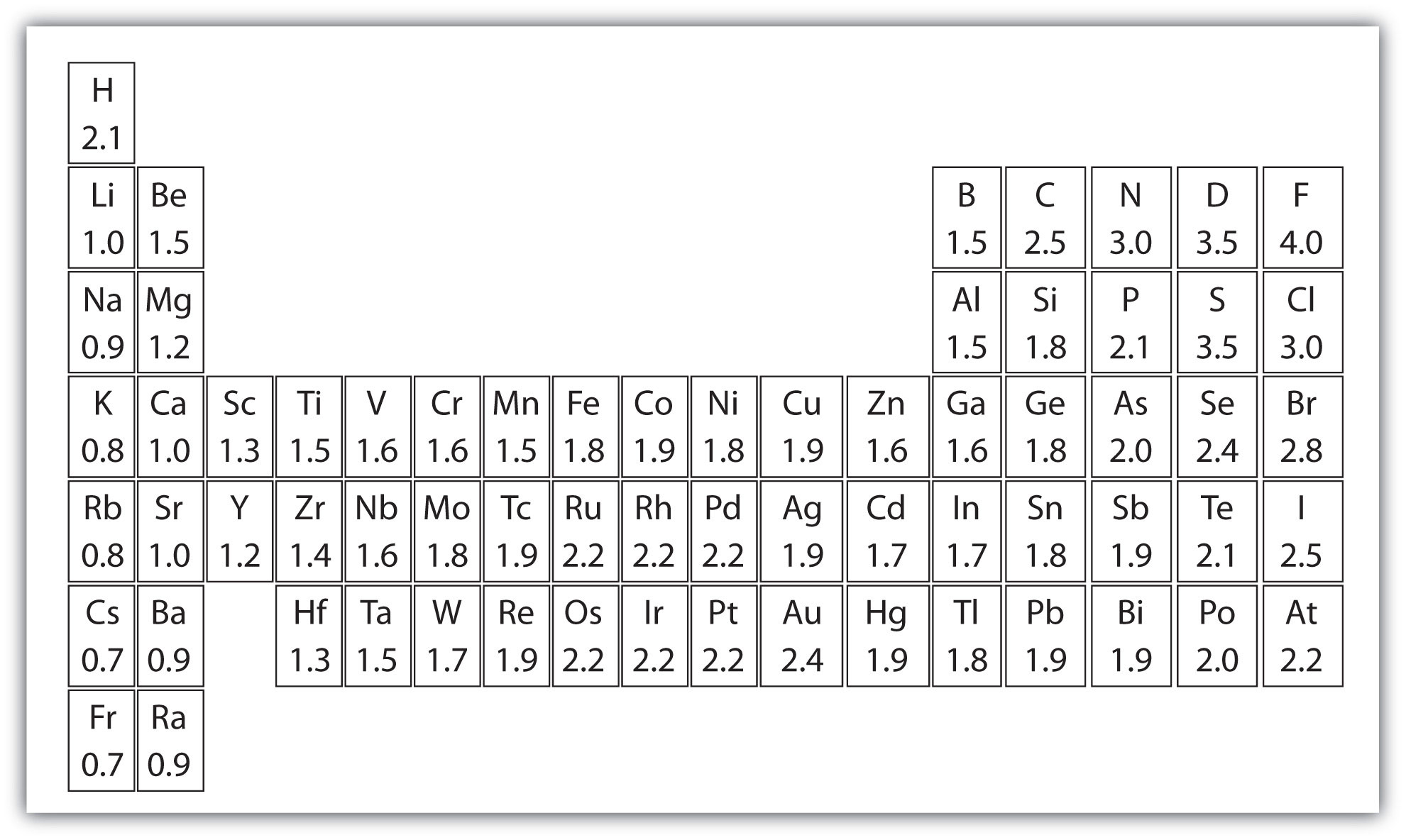
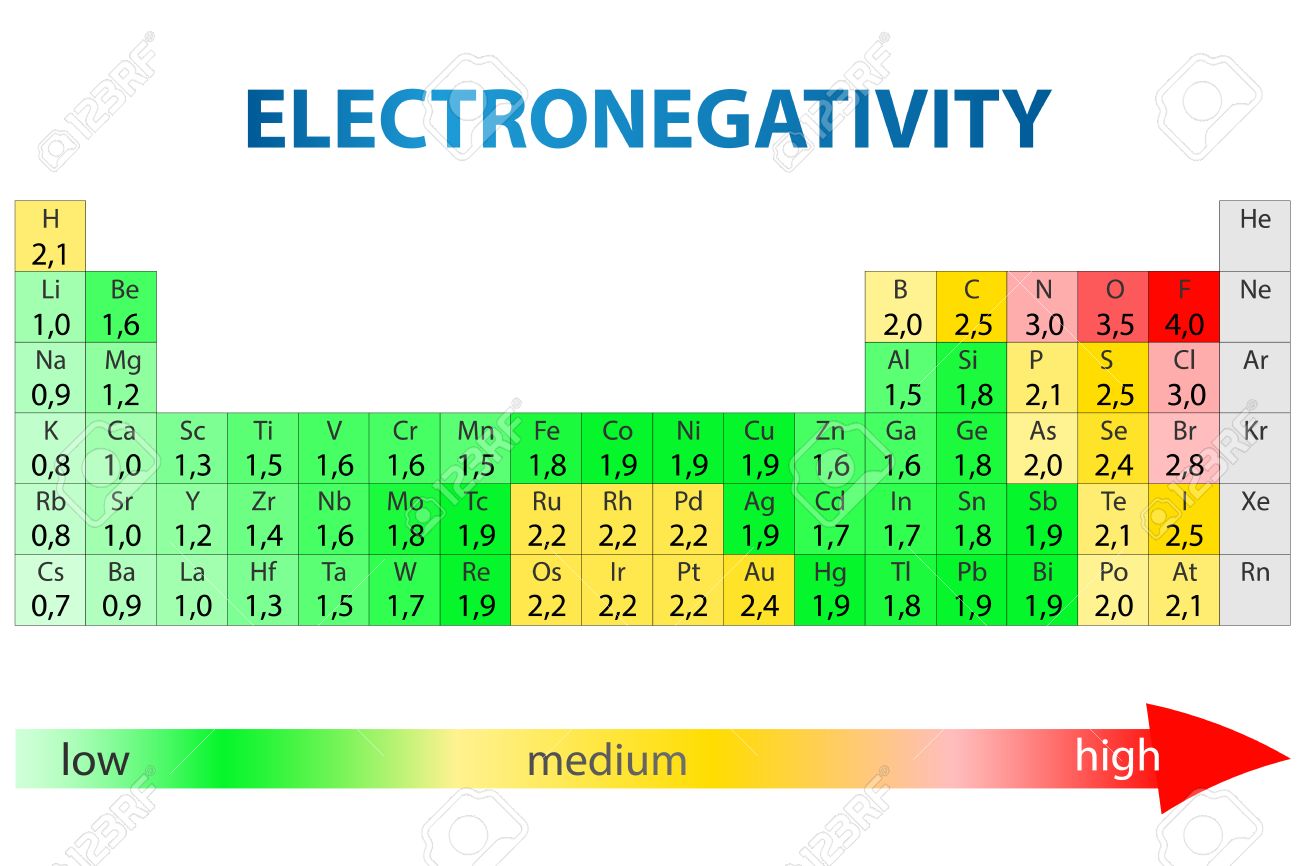
Periódusos rendszer elektronegativitással
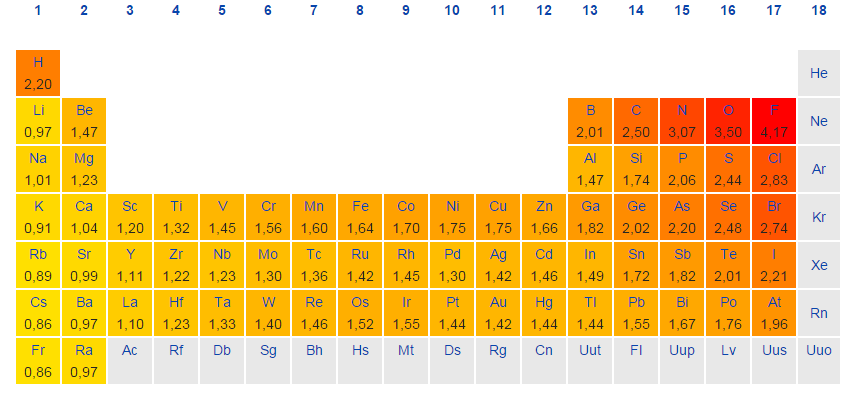

Az elektronegativitás arra utal, hogy egy jód mennyire képes közös elektronokat behúzni egy kovalens kötésben. Minél magasabb az elektronegativitás becslése, annál egyértelműbben húzza be a komponens a közös elektronokat.

Fekete-fehér periódusos rendszer
Az elektronegativitás gondolatát Linus Pauling mutatta be 1932-ben; a Pauling-skálán a fluor 3,98-as elektronegativitást kap, a többi komponens pedig ehhez az értékhez viszonyítva van skálázva. Más elektronegativitási skálák közé tartozik a Robert S. Mulliken által 1934-ben javasolt Mulliken-skála, amelyben a fő ionizációs vitalitás és az elektron részaránya együttesen a középső értéket kapja, valamint az Allred-Rochow-skála, amely a jota magja és a valenciaelektronok közötti elektrosztatikus vonzást méri.

Az elektronegativitás jellemzően az intermittáló táblázatban változik. Az elektronegativitás alulról felfelé növekszik a gyűjteményekben, és balról a megfelelő keresztirányban növekszik az időszakokban. Ezért a fluor a legelektronegatívabb komponens, míg a francium az egyik legkevésbé elektronegatív. (A hélium, a neon és az argon nem szerepel a Pauling-féle elektronegativitási skálán, annak ellenére, hogy az Allred-Rochow-skálán a hélium rendelkezik a legjelentősebb elektronegativitással.)
Interaktív periódusos rendszer
Az interaktív periódusos rendszer arról szól, hogy mennyire ismered a periódusos rendszert, és mennyire foglalkozol vele, ha csak számokat és ábécét látsz benne, de ha megérted, akkor egy teljes világot látsz benne, ami a tudományhoz kapcsolódik, és ez tényleg segít minden szempontból.
Amint tudjuk, ebben nagyon fontosak az atomok, amelyek olyan szubatomi részecskékből állnak, mint a proton, a neutron és az elektron. Ezek a részecskék különböző – különböző elrendezésekkel rendelkeznek az elektronok megadásával, a dolog, amit minden körülmények között emlékeznünk kell, hogy a proton, neutron, elektron pontosan ugyanaz, mint a proton, neutron és elektron különböző más elemek protonja, neutronja és elektronja, alapvetően a szám elrendezése az, ami a különböző elemeket teszi. De előtte általában feltesszük a kérdést, hogy mi a proton, a neutron vagy az elektron, ezért itt megpróbálom megadni a választ.
Interaktív periódusos rendszer gyerekeknek
A proton pozitív töltésű részecske, súlya 1 atomi tömegegység (1,67xgramm), és az atommagban helyezkedik el.
A neutronok semlegesen negatív töltésű részecskék, súlyuk körülbelül 1 atomi tömeg, és az atommagban helyezkednek el.
Az elektronok negatív töltésű részecskék, és súlya nulla atomi tömegegység, és ez az energiaszint különböző orbitáljain található, és az elektronok súlya 9,11x ez azt jelenti, hogy 1830 elektronra van szükség ahhoz, hogy egy proton tömegével megegyezzen.
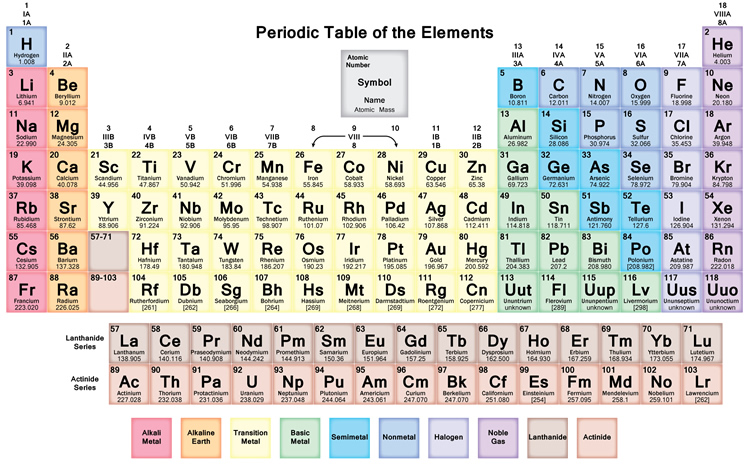
Az anyag összetevőinek alkalmi táblázata az ismert Elemek összefoglalása. A táblázatban a komponenseket a legkisebb számmal kezdődő magszámuk kérésére adjuk meg. Egy komponens magszáma megegyezik az adott atomban lévő protonok számával. A szakaszos táblázatban a komponensek időszakokra és csoportokra vannak osztva. Az összetevők egy oszlopát a táblázatban periódusnak nevezzük. Minden periódusnak van egy száma: 1-től 8-ig. Az 1. periódusban csak 2 komponens található: hidrogén és hélium. A 2. és a 3. periódus egyaránt 8 komponensből áll. A különböző periódusok hosszabbak. Az összetevők egy periódusban folyamatos magszámmal rendelkeznek.
Ingyenes periódusos táblázat PDF
A komponensek egy szakaszát a táblázatban gyűjtésnek nevezzük. A standard alkalmi táblázatban 18 csomó van. Minden egyes gyűlésnek van egy száma: 1-től 18-ig. Az egy csoportban lévő komponensek elektronjait hasonló módon irányítják, ami hasonló összetételi tulajdonságokkal ruházza fel őket (összehasonlítható módon viselkednek). Például a 18-as csoportot a tiszteletreméltó gázok néven ismerik, mivel ezek többnyire gázok, és nem egyesülnek más molekulákkal.

A csoportszámoknak kétféle kerete van; az egyik az arab számokat használja (1,2,3), a másik kettő pedig a római számokat (I, II, III).
A római számneveket használták először, és ezek a megszokott nevek; az arab számnevek modernebb nevek, amelyeket a Nemzetközi Tiszta és Alkalmazott Kémiai Unió (IUPAC) is használt. Az IUPAC-elnevezések célja az volt, hogy kiszorítsák a bevett római számrendszereket. A periódusos rendszert Dmitrij Ivanovics Mendelejev (1834-1907) orosz fizikus találta ki és állította össze. Az ő tiszteletére nevezték el róla a 101. alkotóelemet, a mendeleviumot.
Itt vannak a periódusos rendszer PDF elemei
A periódusos rendszert a vegyészek is használják az elemek közötti mintázat és kapcsolat megfigyelésére, hogy melyik elem melyik elemmel áll kapcsolatban, valamint a periódusos rendszerben 3 fő csoport van: fémek, metalloidok és gázok.
Periódusos rendszer tömeggel
Amint mindannyian tudjuk, minden elemnek egyedi tömege van, amelyet számos szakértő mér egy laboratóriumban, majd az eredmény jön ki, és a tömeg súlya nagyon fontos, mert ez által kapjuk az eredményt, és megkapjuk, hogy milyen elemet használunk az adott kísérlethez.
A tömeg sok szempontból fontos, és a periódusos rendszer által könnyen tudjuk, hogy melyik elemnek mennyi súlya van, ezért ehhez csak le kell tölteni egy periódusos rendszert a tömeggel, hogy ez által tudjuk, hogy mennyi minden tartalmaz. És egy papírlapot is magaddal vihetsz.
Periódusos rendszer orbitálisai
Amint azt mindannyian tudjuk a periódusos rendszerről, minden cellát a saját orbitálisai osztanak fel, és ez egyfajta valószínűségi régió, ahol az elektron megtalálható. És ezeknek az egész régióknak megvan a saját alakjuk.
Minden orbitálisnak megvan a maga egyedisége és minden orbitálisnak megvan a maga blokkja is.
S, P, D, F orbitálisok periódusos rendszer
Ha például az S orbitális az elektron első helye és az atomban található. Aztán a P orbitálisnak megvan a maga egyedisége, hogy már tele van energiaszinttel, az elektronok a következő magasabb orbitális stílusban kezdenek töltődni. A D pályáknak is megvan a maguk egyedisége, hogy van két másik stílus, amit egy kicsit bonyolult megérteni.