Knut Eichhorn-Mulligan, MD, PhD és Ivana K. Kim, MD, Boston
A choroidális naevusok, különösen a kisebbek, gyakoriak. A becslések szerint előfordulási gyakoriságuk az általános népesség 5-10 százaléka között mozog. A Blue Mountains Eye Study a többnyire középkorú fehér ausztrálok prospektíven vizsgált populációjának 6,5 százalékában észlelt chorioideális naevákat.1 A chorioideális melanomák viszont szerencsére ritka entitásnak számítanak, a becsült előfordulási gyakoriságuk körülbelül hat per millió. Mindazonáltal a chorioidea melanoma a leggyakoribb primer intraokuláris malignitás felnőtteknél, és fontos a gyors és pontos diagnózis.
A naevusok jellemzői
Hisztológiailag a naevusok a chorioidea külső rétegeiben található melanociták jóindulatú daganatai. Jellemzően lapos, palaszürke elváltozásként jelennek meg a retina alatt. A naevi azonban az esetek akár 10 százalékában teljesen pigmentálatlan is lehet.2 A rosszindulatú átalakulás kockázata a becslések szerint meglehetősen alacsony.3 Mindazonáltal a naevi képes látási zavarokat okozni, különösen, ha a fovea közelében helyezkedik el. Azáltal, hogy összenyomják a felette lévő choriocapillaris-t, a vastagabb naevusok akadályozhatják az RPE és a külső retinarétegek vérellátását, és RPE- és fotoreceptor-degenerációhoz vezethetnek.4 A naevusok meglepően sok betegnél társultak látótérzavarral, bár ha perifériásak, ezek a hiányok nem feltétlenül válnak tünetessé.5,6 A jóindulatú naevusok kapcsán megfigyelt, vizuálisan jelentősebb szövődmények közé tartozik az RPE és a retina szerózus leválása és a chorioidea neovaszkularizáció.4 A Wills Szemkórházban nemrégiben végzett, több mint 3400 naeviás beteg látásfunkciójának áttekintése azt mutatta, hogy az extrafoveális naeviás betegeknél a látásvesztés becsült kockázata 15 év alatt 2 százalék volt, a subfoveoláris naeviás betegeknél azonban 26 százalék.7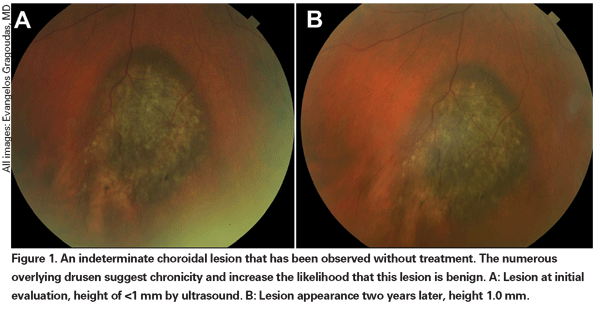
Az, hogy a melanomák a már meglévő naevusokból erednek-e, vagy valójában egy különálló entitásról van szó, némileg ellentmondásos. Enukleált szemek elemzése során kimutatták a rosszindulatú melanomák szélein belül a naevusokra jellemző szövettani jellemzőket, ami arra utal, hogy legalább néhány melanoma kialakulhat a már meglévő naevusokon belüli rosszindulatú átalakulásból.8 Mindazonáltal annak kockázatát, hogy egy choroidalis naevus melanomává alakuljon, általában rendkívül alacsonynak tartják. A rosszindulatú átalakulás éves arányára vonatkozó becslések a 4800-ból egy és 8800-ból egy között mozognak.3,9
A kis choroidális naevusok általában ritkán növekednek. A Blue Mountains tanulmányban 160 olyan naevus (átlagos átmérő 1,25 mm) közül, amelyeknél legalább ötéves követési idő állt rendelkezésre, csak egy mutatott enyhe átmérő-növekedést.10 Ugyanakkor több olyan szövettanilag igazolt choroidális naevusról is beszámoltak, amelyek progresszív megnagyobbodást mutattak, de gondos vizsgálat során nem voltak rosszindulatúak.11,12 Ezenfelül Dr. Carol Shields és munkatársai egy tercier beutalórendelőben követett több mint 2500 szem elemzése során a naevusok 3-4%-ánál észleltek megnagyobbodást a rosszindulatú átalakulás jellemzői nélkül.2 A naevusok ebben a klinikai alapú kohorszban a kiinduláskor jelentősen nagyobbak voltak, mint a populáción alapuló Blue Mountains vizsgálatban, átlagosan körülbelül 5 mm átmérőjűek.

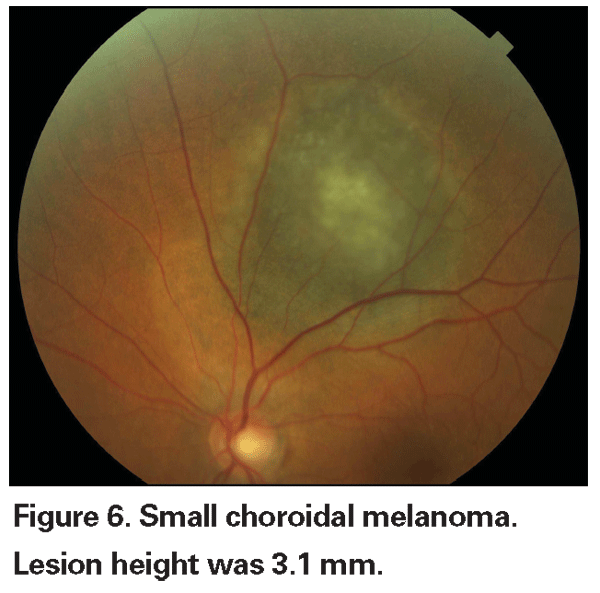
A kis melanomák felismerése
Az enyhén emelkedett, pigmentált choroidális elváltozásokat meghatározhatatlan elváltozásoknak nevezhetjük, és kihívást jelentenek a diagnózis és a kezelés szempontjából. Tekintettel a rosszindulatúság szövettani megerősítésének kockázataira és korlátaira, a szemészorvosoknak a növekedés és áttétképződés előrejelzőjeként azonosított klinikai jellemzőkre kell támaszkodniuk, hogy megkülönböztessék a kis melanomákat a valószínűleg jóindulatú, emelkedett choroidális melanocytás daganatoktól. Dr. Shields és munkatársai mintegy 1300 beteg retrospektív elemzése alapján öt olyan tényezőt azonosítottak, amelyek a kis, 3 mm-nél kisebb vastagságú choroidális melanocytás elváltozások növekedésének kockázatával kapcsolatosak13 : 1) 2,0 mm-nél nagyobb daganatvastagság; 2) szubretinális folyadék; 3) látási tünetek; 4) narancssárga pigment; 5) a korongot érintő hátsó tumorszegély. Az elváltozás növekedését a betegek 4 százalékánál figyelték meg, akiknél egyik kockázati tényező sem szerepelt, 36 százalékánál, akiknél egy kockázati tényező szerepelt, és több mint 50 százalékánál, akiknél három vagy több tényező szerepelt.14 Az áttétképződés fokozott kockázatával összefüggő klinikai tényezők közé tartoztak: 1) a korongot érintő hátsó perem; 2) dokumentált növekedés; és 3) megnövekedett tumorvastagság (1,1 mm-nél nagyobb/egyenlő).13 A Collaborative Ocular Melanoma Study (COMS) csoport által végzett kis tumoros megfigyeléses vizsgálat hasonló kockázati tényezőket azonosított, amelyek a tumor növekedéséhez kapcsolódtak; nevezetesen 1) nagyobb apikális tumorvastagság, 2) nagyobb kezdeti bazális átmérő, 3) narancsszínű pigment jelenléte, 4) drusen hiánya, és 5) a tumor melletti retinális pigmenthám elváltozás hiánya.15 Ez utóbbi két tényező megerősíti azt a klinikai megfigyelést, hogy a drusen és a pigmentelváltozások jelenléte a krónikusság jelzői, és ezért nagyobb valószínűséggel jelennek meg a nyugvó, jóindulatú elváltozások felett. 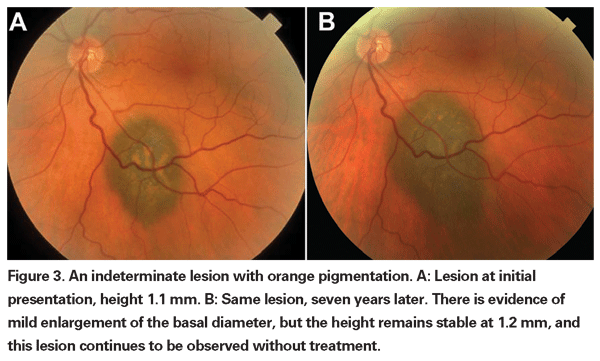
A képalkotó jellemzők szintén hasznosak lehetnek a malignitás lehetőségének értékelésében. A belső nyugalmi zóna jelenléte a B-scan ultrahangvizsgálaton és a forró foltok a fluoreszcein angiográfián a tumor növekedésének előrejelzőinek bizonyultak.16 Az optikai koherencia tomográfia szerepét is vizsgálják a choroidalis elváltozások értékelésében. Dr. Gabriella Espinoza és munkatársai azt javasolták, hogy az OCT értékes lehet az aktív szubretinális folyadék – amikor az elváltozás fölötti retina emelkedett, de egyébként normális megjelenésű – és az olyan krónikus elváltozások, mint a retina elvékonyodása vagy az intraretinális ciszták megkülönböztetésében. Kis sorozatukban összefüggést találtak az OCT-n látható aktív szubretinális folyadék és a dokumentált tumor növekedése között17.
Kora kezelés vs. Megfigyelés
Amikor az enukleáció volt a melanoma egyetlen elfogadott kezelési formája, a kis tumorok esetében, amelyeket a kezdeti megjelenéskor nem lehetett egyértelműen melanomaként diagnosztizálni, a dokumentált növekedésig tartó megfigyelést javasolták. Most, hogy rendelkezésre állnak és bizonyítottan hatékonyak a gömbkímélő terápiák, érvként lehet érvelni az ilyen bizonytalan elváltozások korábbi kezelése mellett. A COMS-vizsgálatokból származó adatok azt mutatják, hogy a melanomával kapcsolatos halálozás a kezelés időpontjában a daganat méretétől függően változik. A közepes méretű daganatok (a 2,5-10 mm-es apikális magasságú és legfeljebb 16 mm-es legnagyobb bazális átmérőjű daganatok) esetében a melanomára jellemző halálozás öt év alatt 10 százalék volt, 10 év alatt pedig 18 százalék18. A nagy tumorok (a közepes tumorok méretkritériumait meghaladó tumorok akár az apikális magasság, akár a legnagyobb bazális átmérő tekintetében; vagy a 8 mm-nél nagyobb apikális magasságú peripapilláris tumorok) esetében az arány öt év múlva körülbelül 27 százalékra, 10 év múlva pedig 40 százalékra emelkedett.19 Emellett, mint már említettük, a kezelés előtti dokumentált növekedés bizonyítottan az áttétképződés kockázati tényezője. A növekedés azonban az agresszívabb tumorok markere lehet, és nem bizonyított, hogy e tumorok korábbi kezelése csökkenti a mortalitást.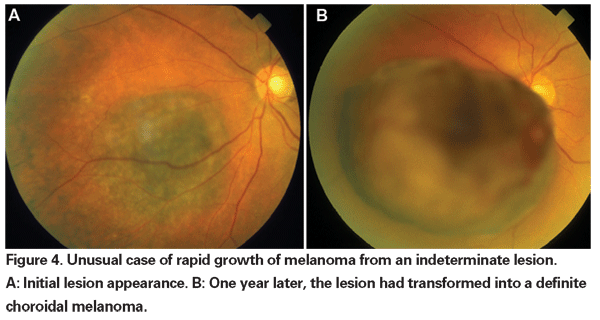
A sugárterápia jelenlegi módszerei lehetővé teszik a hatékony helyi tumorkontrollt a golyva megőrzésével, de a vizuális morbiditás még mindig magas. Ezért szükséges mérlegelni a bizonytalan elváltozások kezelése előtti gondos megfigyeléssel járó halálozási kockázatot a terápia által kiváltott látásvesztés következményeivel szemben. A COMS kis tumoros megfigyelési tanulmányban a kezdeti megfigyelési időszak után kezelt 67 daganatos betegcsoportból hat melanomával kapcsolatos haláleset történt.20 E halálesetek közül csak kettő következett be a felvételt követő öt éven belül, ami megközelítőleg 3 százalékos ötéves melanoma-specifikus halálozási arányt eredményezett. Nemrégiben a Bascom Palmer Szemészeti Intézet kutatói 3,9 százalékos ötéves melanomaspecifikus halálozási arányról számoltak be egy kis betegcsoportban, akiknél feltételezett choroidális melanomát figyeltek meg a növekedés vagy a narancssárga pigment kialakulása miatt a plaque sugárkezelés előtt.21 Ezek a tanulmányok alacsony halálozási arányra utalnak a bizonytalan elváltozások késleltetett kezelésével kapcsolatban. Emellett egy kis retrospektív sorozat nem mutatta ki a melanomára jellemző halálozás növekedését az azonnal kezelt és a kezdetben megfigyelt betegek között.22 A mai napig nincs bizonyíték arra, hogy a melanomaként véglegesen nem diagnosztizálható kis tumorok korábbi, illetve késleltetett kezelése túlélési előnyt jelentene. Ezért nem egyértelmű, hogy a látás feláldozása nagyobb számú, bizonytalan elváltozású betegnél biztosan több életet mentene meg.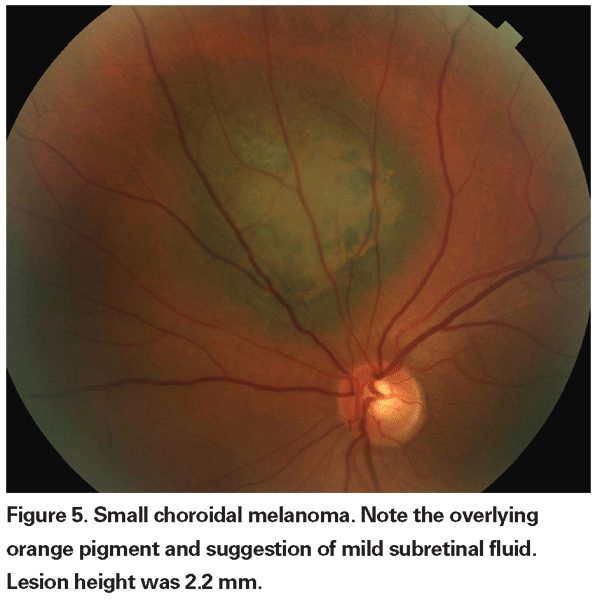
Összefoglalva, a choroidális pigmentált elváltozások három kategóriába sorolhatók: 1) kis, lapos elváltozások, amelyek egyértelműen choroidális naevusok; 2) kis, <2,5 mm magasságú elváltozások, amelyeken narancssárga pigment vagy subretinalis folyadék vagy a rosszindulatúság gyanúját felvető egyéb tényezők valamelyike lehet – az úgynevezett határozatlan elváltozások; és 3) a 2,5 mm-nél nagyobb/egyenletesebb kupola- vagy gomba alakú choroidális daganatok, amelyek egyértelműen melanomák. Az indeterminált elváltozások kezelése még mindig ellentmondásos terület, és ezen elváltozások értékelését és kezelését leginkább szemészeti onkológusok végzik. A bizonytalan elváltozások korai és késleltetett kezelését összehasonlító klinikai vizsgálat nem biztos, hogy megvalósítható a betegek nagy száma és a meggyőző eredményekhez szükséges hosszú követési idő miatt. A molekuláris diagnosztikai technikák folyamatos fejlődése mellett a legjobb remény a chorioidea melanomás betegek túlélésének növelésére az áttétes betegség hatékony kezelésének kifejlesztésében és a rosszindulatú átalakulást pontosabban előrejelző biomarkerek keresésében rejlik.
Dr. Eichhorn-Mulligan a Harvard Medical School szemészeti rezidenseként dolgozik. Dr. Kim a Harvard Medical School szemészeti tanszékén, a Massachusetts Eye and Ear Infirmary retinaszolgálatának adjunktusa.
1. Sumich P, Mitchell P, Wang J. Choroidal naevi fehér populációban – a Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. A choroidális naevusok klinikai spektruma a megjelenéskori életkor alapján 3422 egymást követő szemen. Ophthalmology 2007: Dec 5 .
3. Singh AD, Kalyani P, Topham A. A choroidal naevus rosszindulatú átalakulásának kockázatának becslése. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. A choroidális naevihez társuló látásvesztés. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. A choroidális naevusok klinikai vizsgálata. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. A jóindulatú choroidális melanomák látótérvizsgálatai. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Látásélesség 3422 egymást követő choroidális naevusban szenvedő szemnél. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Az uvea malignus melanomáinak hisztogenezise. II. Az uvealis naevusok és a malignus melanomák kapcsolata. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Jóindulatú naevusok és rosszindulatú melanomák a chorioideában. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. A choroidális naevusok változásának hiánya 5 év alatt egy idősebb populációban. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Egy szövettanilag dokumentált choroidalis naevus megnagyobbodása. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. A dokumentált növekedés hisztopatológiája kis melanocita chorioidea tumorokban. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. A kisméretű choroidális melanocytás elváltozások növekedésének és áttétképződésének kockázati tényezői. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. A kisméretű choroidális melanocytás daganatok növekedését előrejelző klinikai tényezők kombinációja. Arch Ophthalmol 2000;118:360-364.
15. The Collaborative Ocular Melanoma Study Group. A kisméretű chorioideális melanoma növekedését és kezelését előrejelző tényezők. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Az indeterminált pigmentált chorioidea-tumorok természetrajza. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Optikai koherencia tomográfia a gyanús choroidális melanocytás tumorokhoz társuló retinaváltozások értékelésében. Am J Ophthalmol 2004;137:90-95.
18. The Collaborative Ocular Melanoma Study Group. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twelve-year mortality rates and prognostic factors: COMS 28. számú jelentés. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, The Collaborative Ocular Melanoma Study Group. A Collaborative Ocular Melanoma Study (COMS) randomizált vizsgálata a nagy kiterjedésű choroidális melanoma magvakatasztrófa előtti besugárzásával: IV. Tízéves halálozási eredmények és prognosztikai tényezők. COMS 24. sz. jelentés. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Halálozás kis chorioideális melanomás betegeknél. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. A jód 125 plakkos sugárterápia eredményei a kisméretű choroidális melanomák gyanújának kezdeti megfigyelése után. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.