Nach der Kreuzphosphorylierung dienen die zytoplasmatischen Schwänze der RTKs als Andockstellen für verschiedene intrazelluläre Proteine, die an der Signaltransduktion beteiligt sind. Diese Proteine haben eine bestimmte Domäne – SH2 genannt -, die an phosphorylierte Tyrosine in den zytoplasmatischen RTK-Rezeptorschwänzen bindet. Mehr als ein SH2-haltiges Protein kann gleichzeitig an einen aktivierten RTK binden, was die gleichzeitige Aktivierung mehrerer intrazellulärer Signalwege ermöglicht. Letztlich führt die RTK-Aktivierung zu Veränderungen in der Gentranskription. Die Signalübertragung wird komplex, wenn die Signale von der Membran zum Zellkern wandern, was auf das Übersprechen zwischen den Zwischenstufen der verschiedenen Signalwege in der Zelle zurückzuführen ist (Abbildung 1).

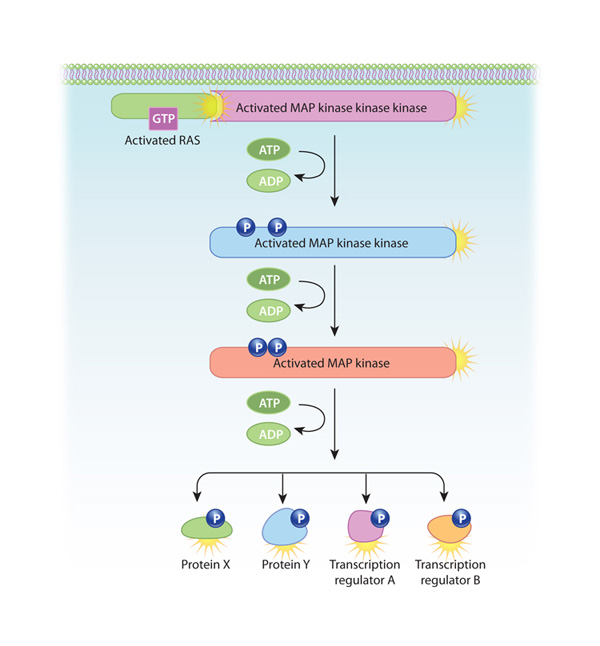
One of the most common intracellular signaling pathways triggered by RTKs is known as the mitogen-activated protein (MAP) kinase cascade, because it involves three serine-threonine kinases. Der Weg beginnt mit der Aktivierung von Ras, einem kleinen G-Protein, das an der Plasmamembran verankert ist. In seinem inaktiven Zustand ist Ras an GDP gebunden. Wenn sich jedoch SH2-haltige Proteine mit aktivierten RTKs verbinden, veranlassen sie Ras, GTP anstelle von GDP zu binden und aktiv zu werden. Anschließend aktiviert das GTP-gebundene Ras (das selbst keine Kinase ist) die erste Serin-Threonin-Kinase in der MAP-Kinase-Kaskade. Jede der drei Kinasen in dieser Kaskade aktiviert dann die nächste, indem sie sie phosphoryliert. Da alle drei Kinasen in diesem Signalweg mehrere Substrate phosphorylieren, wird das Ausgangssignal bei jedem Schritt verstärkt. Anschließend phosphoryliert das letzte Enzym des Weges die Transkriptionsregulatoren, was zu einer Veränderung der Gentranskription führt (Abbildung 2). Viele Wachstumsfaktoren, darunter der Nervenwachstumsfaktor und der aus Blutplättchen gewonnene Wachstumsfaktor, nutzen diesen Weg.
Nicht alle RTKs nutzen die MAP-Kinase-Kaskade, um Informationen an den Zellkern zu senden. So aktivieren beispielsweise insulinähnliche Wachstumsfaktor-Rezeptoren das Enzym Phosphoinositid-3-Kinase, das Inositolphospholipide in der Zellmembran phosphoryliert, was wiederum zu einer Proteinkinase-Kaskade führt (die sich von der MAP-Kinase-Kaskade unterscheidet), die das Signal an den Zellkern weiterleitet. Andere RTKs verwenden einen direkteren Weg zum Zellkern. Transkriptionsregulatoren, die als STAT-Proteine bekannt sind, ein Akronym für Signaltransduktoren und Aktivatoren der Transkription, binden an die phosphorylierten Tyrosine in den Rezeptoren für Zytokine und einige Hormone. Sobald sie aktiviert sind, wandern die STAT-Proteine direkt in den Zellkern und bewirken dort Veränderungen in der Transkription.