Az RTK-k citoplazmatikus farkai keresztfoszforiláció után a jelátvitelben részt vevő különböző intracelluláris fehérjék számára dokkoló platformként szolgálnak. Ezeknek a fehérjéknek van egy speciális – SH2-nek nevezett – doménjük, amely a citoplazmatikus RTK-receptor-farkak foszforilált tirozinjaihoz kötődik. Egynél több SH2-tartalmú fehérje kötődhet egyszerre egy aktivált RTK-hoz, lehetővé téve több intracelluláris jelátviteli útvonal egyidejű aktiválását. Végső soron az RTK-aktiváció változásokat idéz elő a géntranszkripcióban. A jelátvitel összetetté válik, ahogy a jelek a membránból a sejtmagba jutnak, a sejtben lévő különböző jelátviteli útvonalak közvetítői közötti keresztbeszélgetés miatt (1. ábra).

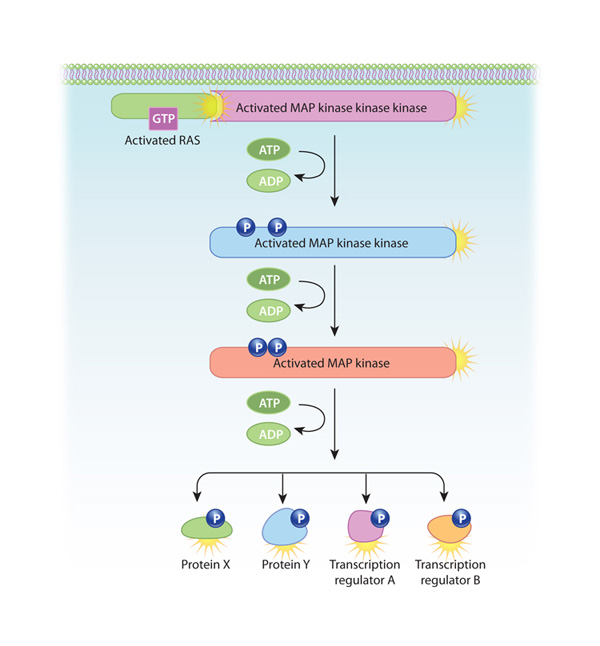
One of the most common intracellular signaling pathways triggered by RTKs is known as the mitogen-activated protein (MAP) kinase cascade, because it involves three serine-threonine kinases. Az útvonal a Ras, egy kis G-fehérje aktiválásával kezdődik, amely a plazmamembránhoz rögzül. Inaktív állapotában a Ras GDP-hez kötődik. Amikor azonban SH2-tartalmú fehérjék csatlakoznak az aktivált RTK-khez, a Ras-t arra késztetik, hogy a GDP helyett GTP-t kössön és aktívvá váljon. Ezután a GTP-hez kötött Ras (amely maga nem kináz) aktiválja a MAP-kináz kaszkád első szerin-treonin kinázát. A kaszkád három kináza közül mindegyik aktiválja a következőt foszforilálással. Mivel ebben az útvonalban mindhárom kináz több szubsztrátot foszforilál, a kezdeti jel minden egyes lépésnél felerősödik. Ezután az útvonal utolsó enzimje foszforilálja a transzkripciós regulátorokat, ami a génátírás változásához vezet (2. ábra). Számos növekedési faktor, köztük az idegi növekedési faktor és a vérlemezke-eredetű növekedési faktor használja ezt az útvonalat.
Nem minden RTK használja a MAP-kináz kaszkádot, hogy információt küldjön a sejtmagba. Például az inzulinszerű növekedési faktor receptorok aktiválják a foszfoinozid-3-kináz enzimet, amely foszforilálja az inozitol-foszfolipideket a sejtmembránban, ami viszont egy (a MAP-kináz kaszkádtól eltérő) fehérje-kináz kaszkádhoz vezet, amely továbbítja a jelet a sejtmagba. Más RTK-k közvetlenebb úton jutnak el a sejtmagba. A STAT-fehérjékként ismert transzkripciós regulátorok – a jelátvivők és transzkripcióaktivátorok rövidítése – a citokinek és egyes hormonok receptorainak foszforilált tirozinjaihoz kötődnek. Aktiválásukat követően a STAT-fehérjék közvetlenül a sejtmagba jutnak, és változásokat okoznak a transzkripcióban.