Dies ist ein kurzer Überblick über die Informationen im Zusammenhang mit der FDA-Zulassung für dieses Produkt. Vollständigere Informationen über dieses Produkt, seine Anwendungsgebiete und die Grundlage für die FDA-Zulassung finden Sie unter den nachstehenden Links zur Zusammenfassung der Sicherheits- und Wirksamkeitsdaten (SSED) und zur Produktkennzeichnung.
Produktname: Inspire® Upper Airway Stimulation (UAS)
PMA-Antragsteller: Inspire Medical Systems, Inc.
Adresse: 5500 Wayzata Blvd. Suite 1600
Golden Valley, MN 55416 US
Zulassungsdatum: April 14, 2020
Genehmigungsschreiben: Approval Order
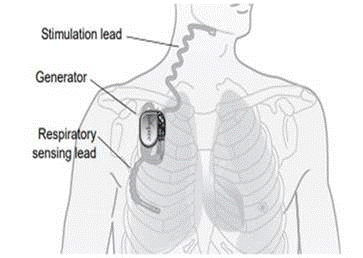
Was ist das? Das Inspire®-System zur Stimulation der oberen Atemwege (UAS) ist ein implantierbarer Nervenstimulator, der zur Behandlung von mittelschwerer bis schwerer obstruktiver Schlafapnoe (OSA) eingesetzt wird. Das Inspire® UAS-System besteht aus implantierten Komponenten wie dem implantierbaren Impulsgenerator (IPG), der Stimulationsleitung und der Messleitung sowie aus externen Komponenten wie dem Arztprogrammiergerät und dem Patientenprogrammiergerät.
Diese Zulassung erweitert die Indikationen für den Einsatz des Inspire® UAS bei Patienten im Alter von 18 bis 21 Jahren mit mittelschwerer bis schwerer OSA, die:
- Nicht vollständige Blockade der oberen Atemwege
- Nicht in der Lage sind, die Mandeln und andere Weichteile hinter der Nase zu entfernen, oder diese nicht wirksam behandeln können
- Nicht in der Lage sind, eine PAP-Therapie zu vertragen oder diese trotz aller Versuche, die Compliance zu verbessern, nicht vertragen
- Die Standardtherapie unter Berücksichtigung aller anderen alternativen/ergänzenden Therapien befolgt haben
Wie funktioniert es? Der implantierbare Impulsgenerator erkennt das Atemmuster des Patienten und hält die Atemwege mit einer leichten Nervenstimulation offen. Der Arzt kann die Stimulationseinstellungen mithilfe des externen Programmiergeräts konfigurieren. Mit der Patienten-Schlaf-Fernbedienung kann der Patient die Therapie vor dem Einschlafen ein- und nach dem Aufwachen wieder ausschalten.
Wann wird es eingesetzt? Das Inspire® UAS-System wird zur Behandlung einer Untergruppe von Patienten mit mittelschwerer bis schwerer OSA eingesetzt. Der Schweregrad der Apnoe (Atemstillstand) oder Hypopnoe (teilweiser Atemstillstand) wird anhand einer Skala, dem Apnoe-Hypopnoe-Index (AHI), bestimmt. Eine mittelschwere bis schwere OSA wird mit einem AHI von 15 oder mehr und 65 oder weniger beschrieben. Inspire® UAS wird bei erwachsenen Patienten ab 18 Jahren eingesetzt, bei denen eine Behandlung mit positivem Atemwegsdruck (PAP) (z. B. kontinuierlicher positiver Atemwegsdruck oder zweistufige positive Atemwegsdruckgeräte) nachweislich versagt oder nicht vertragen wird und die keine vollständige Blockade der oberen Atemwege aufweisen.
PAP-Versagen ist definiert als Unfähigkeit, OSA zu beseitigen (AHI von mehr als 15 trotz PAP-Anwendung), und PAP-Intoleranz ist definiert als:
- Unfähigkeit, PAP zu verwenden (mehr als 5 Nächte pro Woche; Verwendung definiert als mehr als 4 Stunden Verwendung pro Nacht), oder
- Unwilligkeit, PAP zu verwenden (z. B. gibt ein Patient das PAP-System zurück, nachdem er versucht hat, es zu verwenden).
Was soll damit erreicht werden? Einhundertsechsundzwanzig (126) Patienten nahmen an einer klinischen Studie in 22 Prüfzentren teil, um die ursprüngliche Zulassung von Inspire® UAS zu unterstützen. Die Inspire® UAS-Therapie führte bei der Mehrheit der Patienten zu einer klinisch bedeutsamen Verringerung des Schweregrads ihrer obstruktiven Schlafapnoe und zu einer Verbesserung ihrer Lebensqualität. Mehr als die Hälfte aller Patienten wurde als Responder auf die Inspire® UAS Therapie eingestuft, die eine mindestens 50%ige Reduktion des AHI und einen AHI von weniger als 20 Ereignissen pro Stunde am 12-Monats-Endpunkt aufwiesen. Bei den Respondern der Inspire® UAS-Therapie verringerte sich auch der Sauerstoffentsättigungsindex (ODI), eine Skala, die den Schweregrad der Schlafapnoe anzeigt, um mindestens 25 %. Die Ergebnisse dieser Studie sowie einer kleinen klinischen Studie an pädiatrischen Patienten mit Down-Syndrom sprechen für eine Ausweitung der Indikation auf ältere Jugendliche zwischen 18 und 21 Jahren.
Wann sollte es nicht eingesetzt werden? Das Inspire® UAS System sollte nicht für die folgenden Zwecke verwendet werden:
- Apnoe-Typen (zentral und gemischt), die nicht obstruktiv sind, machen mehr als 25 % des gesamten AHI aus
- Jeder körperliche Befund, der die Durchführung der Stimulation der oberen Atemwege beeinträchtigen würde, wie z. B. das Vorhandensein einer vollständigen Blockade der oberen Atemwege
- Jede Erkrankung oder Prozedur, die die neurologische Kontrolle der oberen Atemwege beeinträchtigt hat
- Patienten, die nicht in der Lage sind oder nicht über die nötige Unterstützung verfügen, um die Schlaffernbedienung zu bedienen
- Patienten, die schwanger sind oder eine Schwangerschaft planen
- Patienten mit einem implantierbaren Gerät, das für eine unbeabsichtigte Interaktion mit dem Inspire®-System anfällig sein könnte. Wenden Sie sich an den Hersteller des Geräts, um die Möglichkeit einer Wechselwirkung zu beurteilen.
- Patienten, bei denen eine Magnetresonanztomographie (MRT) erforderlich ist, die nicht in der MR-Kennzeichnung angegeben ist
Zusätzliche Informationen (einschließlich Warnungen, Vorsichtsmaßnahmen und unerwünschte Ereignisse):
- Zusammenfassung der Daten zur Sicherheit und Wirksamkeit (SSED)
- Beschriftung durch den Arzt
- Beschriftung durch den Patienten
- PMA-Datenbankeintrag