Jest to krótki przegląd informacji związanych z zatwierdzeniem przez FDA do obrotu tego produktu. Pełniejsze informacje na temat tego produktu, wskazań do jego stosowania oraz podstawy zatwierdzenia przez FDA znajdują się w poniższych linkach do streszczenia danych dotyczących bezpieczeństwa i skuteczności (SSED) oraz etykiety produktu.
Nazwa produktu: Inspire® Upper Airway Stimulation (UAS)
PMA Wnioskodawca: Inspire Medical Systems, Inc.
Adres: 5500 Wayzata Blvd. Suite 1600
Golden Valley, MN 55416 US
Data zatwierdzenia: 14 kwietnia 2020
List zatwierdzający: Approval Order
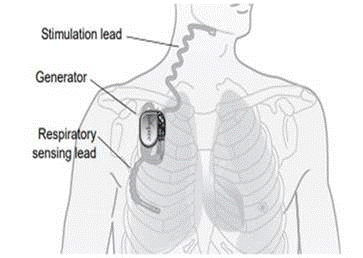
Co to jest? System Inspire® do stymulacji górnych dróg oddechowych (UAS) to wszczepialny stymulator nerwowy stosowany w leczeniu umiarkowanego do ciężkiego obturacyjnego bezdechu sennego (OSA). System Inspire® UAS składa się z elementów wszczepianych, w tym wszczepialnego generatora impulsów (IPG), elektrody stymulującej i elektrody czujnikowej oraz elementów zewnętrznych, takich jak programator lekarski i programator pacjenta.
Niniejsze zatwierdzenie rozszerza wskazania do stosowania systemu Inspire® UAS u pacjentów w wieku od 18 do 21 lat z umiarkowanym lub ciężkim OSA, którzy:
- Nie mają całkowitej blokady górnych dróg oddechowych
- Nie są w stanie lub nie są skutecznie leczeni przez usunięcie migdałków i innych tkanek miękkich za nosem
- Potwierdzono niepowodzenie lub brak tolerancji terapii PAP pomimo prób poprawy zgodności
- Postępowali zgodnie ze standardem opieki przy rozważaniu wszystkich innych alternatywnych/dodatkowych terapii
Jak to działa? Wszczepialny generator impulsów wykrywa wzorzec oddychania pacjenta i utrzymuje drożność dróg oddechowych za pomocą łagodnej stymulacji nerwowej. Lekarz jest w stanie skonfigurować ustawienia stymulacji za pomocą zewnętrznego programatora lekarza. Pilot zdalnego sterowania pozwala pacjentowi włączyć terapię przed zaśnięciem i wyłączyć ją po przebudzeniu.
Kiedy jest używany? System Inspire® UAS jest stosowany w leczeniu podgrupy pacjentów z umiarkowanym do ciężkiego OSA. Ciężkość bezdechu (utrata oddechu) lub hipopnea (częściowa utrata oddechu) jest określana za pomocą skali zwanej wskaźnikiem bezdechu-hipopnea (AHI). Umiarkowany do ciężkiego OSA jest opisywany jako AHI większy lub równy 15 i mniejszy lub równy 65. Inspire® UAS jest stosowany u dorosłych pacjentów w wieku 18 lat i starszych, u których potwierdzono brak skuteczności lub niemożność tolerowania terapii dodatnim ciśnieniem w drogach oddechowych (PAP) (takich jak ciągłe dodatnie ciśnienie w drogach oddechowych lub urządzenia do dwupoziomowego dodatniego ciśnienia w drogach oddechowych) i u których nie występuje całkowita blokada górnych dróg oddechowych.
Niewydolność PAP definiuje się jako niemożność wyeliminowania OSA (AHI większy niż 15 pomimo stosowania PAP), a nietolerancję PAP definiuje się jako:
- Niezdolność do stosowania PAP (stosowanie przez ponad 5 nocy w tygodniu; stosowanie zdefiniowane jako ponad 4 godziny stosowania na noc) lub
- Niechęć do stosowania PAP (na przykład pacjent zwraca system PAP po próbie jego zastosowania).
Co to da? Stu dwudziestu sześciu (126) pacjentów uczestniczyło w badaniu klinicznym w 22 ośrodkach badawczych w celu wsparcia pierwotnego zatwierdzenia Inspire® UAS. Terapia Inspire® UAS zapewniła większości pacjentów znaczące klinicznie zmniejszenie nasilenia obturacyjnego bezdechu sennego i poprawę jakości życia. Ponad połowa pacjentów została uznana za pacjentów, którzy odpowiedzieli na terapię Inspire® UAS, doświadczając co najmniej 50% redukcji AHI i AHI poniżej 20 zdarzeń na godzinę w 12-miesięcznym punkcie końcowym. Uczestnicy terapii Inspire® UAS doświadczyli również co najmniej 25% redukcji wskaźnika desaturacji tlenu (ODI), skali używanej do określenia ciężkości bezdechu sennego. Wyniki tego badania w połączeniu z niewielkim badaniem klinicznym u pacjentów pediatrycznych z zespołem Downa stanowiły poparcie dla rozszerzenia wskazań do stosowania systemu na starszą młodzież w wieku od 18 do 21 lat.
Kiedy nie należy go stosować? System Inspire® UAS nie powinien być używany do następujących celów:
- Typy bezdechu (centralny i mieszany) inne niż obturacyjny stanowią więcej niż 25% całkowitego AHI
- Jakiekolwiek fizyczne odkrycie, które mogłoby zagrozić wykonaniu stymulacji górnych dróg oddechowych, takie jak obecność całkowitej blokady górnych dróg oddechowych
- Jakiekolwiek schorzenie lub zabieg, które upośledziły neurologiczną kontrolę nad górnymi drogami oddechowymi
- Pacjenci, którzy nie są w stanie lub nie mają niezbędnej pomocy w obsłudze pilota do snu
- Pacjenci w ciąży lub planujący ciążę
- Pacjenci z urządzeniem do implantacji, które może być podatne na niezamierzoną interakcję z systemem Inspire®. Należy skonsultować się z producentem urządzenia, aby ocenić możliwość interakcji.