Este es un breve resumen de la información relacionada con la aprobación de la FDA para comercializar este producto. Consulte los enlaces siguientes al Resumen de Datos de Seguridad y Eficacia (SSED) y al etiquetado del producto para obtener información más completa sobre este producto, sus indicaciones de uso y la base de la aprobación de la FDA.
Nombre del producto: Inspire® Upper Airway Stimulation (UAS)
Solicitante de la PMA: Inspire Medical Systems, Inc.
Dirección: 5500 Wayzata Blvd. Suite 1600
Golden Valley, MN 55416 US
Fecha de aprobación: 14 de abril de 2020
Carta de aprobación: Orden de aprobación
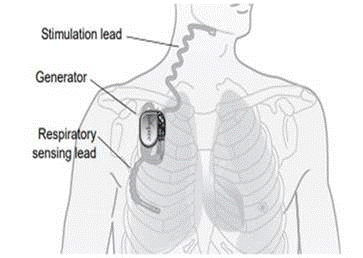
¿Qué es? El sistema Inspire® Upper Airway Stimulation (UAS) es un estimulador nervioso implantable utilizado para tratar la apnea obstructiva del sueño (AOS) de moderada a grave. El sistema Inspire® UAS consta de componentes implantados que incluyen el generador de impulsos implantable (IPG), el cable de estimulación y el cable de detección y componentes externos como el programador del médico y el programador del paciente.
Esta aprobación amplía las indicaciones de uso del Inspire® UAS en pacientes de entre 18 y 21 años con AOS de moderada a grave que:
- No tengan una obstrucción completa de las vías respiratorias superiores
- No puedan, o no sean tratados eficazmente, con la extirpación de las amígdalas y otros tejidos blandos detrás de la nariz
- Se haya confirmado que el tratamiento con PAP no funciona, o no lo toleran, a pesar de los intentos de mejorar el cumplimiento
- Hayan seguido el estándar de atención al considerar todas las demás terapias alternativas/adicionales
¿Cómo funciona? El generador de impulsos implantable detecta el patrón de respiración del paciente y mantiene la vía aérea abierta con una leve estimulación nerviosa. El médico puede configurar los ajustes de estimulación mediante el programador médico externo. El control remoto de sueño del paciente permite que éste encienda la terapia antes de irse a dormir y la apague cuando se despierte.
¿Cuándo se utiliza? El sistema Inspire® UAS se utiliza para tratar un subconjunto de pacientes con AOS de moderada a grave. La gravedad de la apnea (pérdida de aire) o la hipopnea (pérdida parcial de aire) se determina mediante una escala denominada índice de apnea-hipopnea (IAH). La AOS de moderada a grave se describe como un IAH mayor o igual a 15 y menor o igual a 65. Inspire® UAS se utiliza en pacientes adultos de 18 años o más en los que se ha confirmado que los tratamientos de presión positiva en las vías respiratorias (PAP) (como la presión positiva continua en las vías respiratorias o las máquinas de presión positiva en las vías respiratorias de dos niveles) no funcionan o no toleran la obstrucción completa de las vías respiratorias superiores.
El fracaso de la PAP se define como la incapacidad de eliminar la AOS (IAH superior a 15 a pesar del uso de la PAP), y la intolerancia a la PAP se define como:
- La incapacidad de usar la PAP (más de 5 noches por semana de uso; el uso se define como más de 4 horas de uso por noche), o
- La falta de voluntad de usar la PAP (por ejemplo, un paciente devuelve el sistema de PAP después de intentar usarlo).
¿Qué se va a conseguir? Ciento veintiséis (126) pacientes participaron en un estudio clínico en 22 centros de investigación para apoyar la aprobación original de Inspire® UAS. El tratamiento con Inspire® UAS proporcionó a la mayoría de los pacientes reducciones clínicamente significativas en la gravedad de su apnea obstructiva del sueño y mejoras en su calidad de vida. Más de la mitad de los pacientes se consideraron respondedores a la terapia Inspire® UAS, ya que experimentaron una reducción de al menos el 50% del IAH y un IAH inferior a 20 eventos por hora en el punto final de 12 meses. Los pacientes que respondieron a la terapia Inspire® UAS también experimentaron una reducción de al menos un 25% en el índice de desaturación de oxígeno (ODI), una escala utilizada para indicar la gravedad de la apnea del sueño. Los resultados de este estudio, además de un pequeño estudio clínico en pacientes pediátricos con síndrome de Down, respaldaron la ampliación de las indicaciones para incluir a los adolescentes mayores de entre 18 y 21 años.
¿Cuándo no debe utilizarse? El sistema Inspire® UAS no debe utilizarse para lo siguiente:
- Los tipos de apnea (central y mixta) que no sean obstructivos son más del 25% del IAH total
- Cualquier hallazgo físico que comprometa la realización de la estimulación de las vías respiratorias superiores, como la presencia de una obstrucción completa de las vías respiratorias superiores
- Cualquier condición o procedimiento que haya comprometido el control neurológico de las vías respiratorias superiores
- Pacientes que no puedan o no tengan la asistencia necesaria para manejar el control remoto del sueño
- Pacientes que estén embarazadas o tengan previsto quedarse embarazadas
- Pacientes con un dispositivo implantable que pueda ser susceptible de interactuar involuntariamente con el sistema Inspire®. Consulte al fabricante del dispositivo para evaluar la posibilidad de interacción.
- Pacientes que requieran una resonancia magnética (RM) distinta de la especificada en el etiquetado condicional de RM
- Resumen de los datos de seguridad y eficacia (SSED)
- Etiquetado para médicos
- Etiquetado para pacientes
- Ingreso en la base de datos de la PMA
Información adicional (incluyendo advertencias, precauciones y acontecimientos adversos):
- .