Questa è una breve panoramica delle informazioni relative all’approvazione della FDA per la commercializzazione di questo prodotto. Vedere i link sottostanti al Riassunto dei dati di sicurezza ed efficacia (SSED) e all’etichettatura del prodotto per informazioni più complete su questo prodotto, sulle sue indicazioni d’uso e sulle basi per l’approvazione della FDA.
Nome del prodotto: Stimolazione delle vie aeree superiori (UAS) Inspire®
PMA Richiedente: Inspire Medical Systems, Inc.
Indirizzo: 5500 Wayzata Blvd. Suite 1600
Golden Valley, MN 55416 US
Data di approvazione: 14 aprile 2020
Lettera di approvazione: Ordine di approvazione
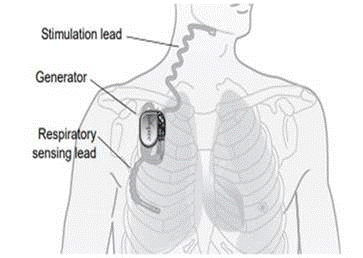
Che cos’è? Il sistema Inspire® Upper Airway Stimulation (UAS) è uno stimolatore nervoso impiantabile usato per trattare l’apnea ostruttiva del sonno (OSA) da moderata a grave. Il sistema Inspire® UAS è costituito da componenti impiantati tra cui il generatore di impulsi impiantabile (IPG), l’elettrocatetere di stimolazione e l’elettrocatetere di rilevamento e da componenti esterni come il programmatore medico e il programmatore paziente.
Questa approvazione amplia le indicazioni per l’uso dell’Inspire® UAS in pazienti di età compresa tra i 18 e i 21 anni con OSA da moderata a grave che:
- Non hanno un’ostruzione completa delle vie aeree superiori
- Non sono in grado, o non sono efficacemente trattati dalla rimozione delle tonsille e di altri tessuti molli dietro il naso
- È stato confermato che non riescono, o non possono tollerare, la terapia PAP nonostante i tentativi di migliorare la compliance
- Hanno seguito lo standard di cura considerando tutte le altre terapie alternative/aggiuntive
Come funziona? Il generatore di impulsi impiantabile rileva il modello di respirazione del paziente e mantiene le vie aeree aperte con una leggera stimolazione nervosa. Il medico è in grado di configurare le impostazioni di stimolazione utilizzando il programmatore medico esterno. Il telecomando per il sonno del paziente permette al paziente di attivare la terapia prima di andare a dormire e di disattivarla quando si sveglia.
Quando si usa? Il sistema Inspire® UAS è usato per trattare un sottogruppo di pazienti con OSA da moderata a grave. La gravità dell’apnea (perdita del respiro) o dell’ipopnea (perdita parziale del respiro) è determinata da una scala chiamata indice di apnea-ipopnea (AHI). La OSA da moderata a grave è descritta come un AHI maggiore o uguale a 15 e minore o uguale a 65. Inspire® UAS è usato in pazienti adulti di 18 anni e più che hanno confermato di non riuscire o non poter tollerare i trattamenti a pressione positiva delle vie aeree (PAP) (come la pressione positiva continua delle vie aeree o le macchine a pressione positiva bi-level delle vie aeree) e che non hanno un blocco completo delle vie aeree superiori.
Il fallimento della PAP è definito come un’incapacità di eliminare l’OSA (AHI superiore a 15 nonostante l’uso della PAP), e l’intolleranza alla PAP è definita come:
- Incapacità di usare la PAP (più di 5 notti a settimana di uso; uso definito come più di 4 ore di uso per notte), o
- Non volontà di usare la PAP (per esempio, un paziente restituisce il sistema PAP dopo aver cercato di usarlo).
Che cosa si ottiene? Centoventisei (126) pazienti hanno partecipato a uno studio clinico in 22 siti sperimentali per sostenere l’approvazione originale di Inspire® UAS. La terapia Inspire® UAS ha fornito alla maggior parte dei pazienti riduzioni clinicamente significative nella gravità della loro apnea ostruttiva del sonno e miglioramenti nella loro qualità della vita. Più della metà di tutti i pazienti sono stati considerati rispondenti alla terapia Inspire® UAS, sperimentando almeno una riduzione del 50% dell’AHI e un AHI inferiore a 20 eventi all’ora all’endpoint di 12 mesi. I pazienti che hanno risposto alla terapia Inspire® UAS hanno anche sperimentato almeno una riduzione del 25% dell’indice di desaturazione dell’ossigeno (ODI), una scala utilizzata per indicare la gravità dell’apnea notturna. I risultati di questo studio, oltre a un piccolo studio clinico in pazienti pediatrici con sindrome di Down, hanno fornito il supporto per espandere le indicazioni per includere adolescenti più grandi tra i 18 e i 21 anni.
Quando non dovrebbe essere usato? Il sistema Inspire® UAS non deve essere usato per i seguenti scopi:
- Tipi di apnea (centrale e mista) diversi da quelli ostruttivi sono superiori al 25% dell’AHI totale
- Qualsiasi reperto fisico che comprometta le prestazioni della stimolazione delle vie aeree superiori, come la presenza di un blocco completo delle vie aeree superiori
- Qualsiasi condizione o procedura che abbia compromesso il controllo neurologico delle vie aeree superiori
- Pazienti che non sono in grado o non hanno l’assistenza necessaria per utilizzare il telecomando per il sonno
- Pazienti che sono in gravidanza o che prevedono una gravidanza
- Pazienti con un dispositivo impiantabile che può essere suscettibile di interazione non intenzionale con il sistema Inspire®. Consultare il produttore del dispositivo per valutare la possibilità di interazione.
- Pazienti che richiedono una risonanza magnetica (MRI) diversa da quella specificata nell’etichettatura MR conditional
Informazioni aggiuntive (incluse avvertenze, precauzioni ed eventi avversi):
- Summary of Safety and Effectiveness Data (SSED)
- Etichettatura per il medico
- Etichettatura per il paziente
- Inserimento nel database PMA