学習の目的
- 周期表における原子の配置を、ns、np、nd、nf 軌道の充填に対応するブロックに関連付ける
学習したように、元素の電子配置は周期表のその他の特異な形状を説明するものである。 周期表はもともと、グループ内の元素の物理的および化学的な類似性に基づいて構成されていましたが、これらの類似性は最終的に、軌道エネルギー準位とパウリ原理に起因しており、これにより個々の副殻が特定の順序で満たされることになります。 その結果、周期表は図に示すように、充填される副殻の種類に応じた「ブロック」に分けられる。 例えば、左側の2列はsブロックと呼ばれ、ns軌道が充填されている元素で構成されています。 右側の6列はnp軌道が充填されている要素で、pブロックを構成しています。 その間の10列はdブロックと呼ばれ、(n – 1)d軌道が満たされている要素である。 その下に14列のfブロックがあり、(n – 2)個のf軌道が埋まっている要素である。 1つの軌道に2個の電子が入るので、各ブロックの列数は、その部分殻の最大電子数と同じで、nsは2、npは6、(n – 1)d は10、(n – 2)f は14である。 各列の中で、各元素は同じ価電子配置を持つ。例えば、ns1(第1族)、ns2np1(第13族)である。
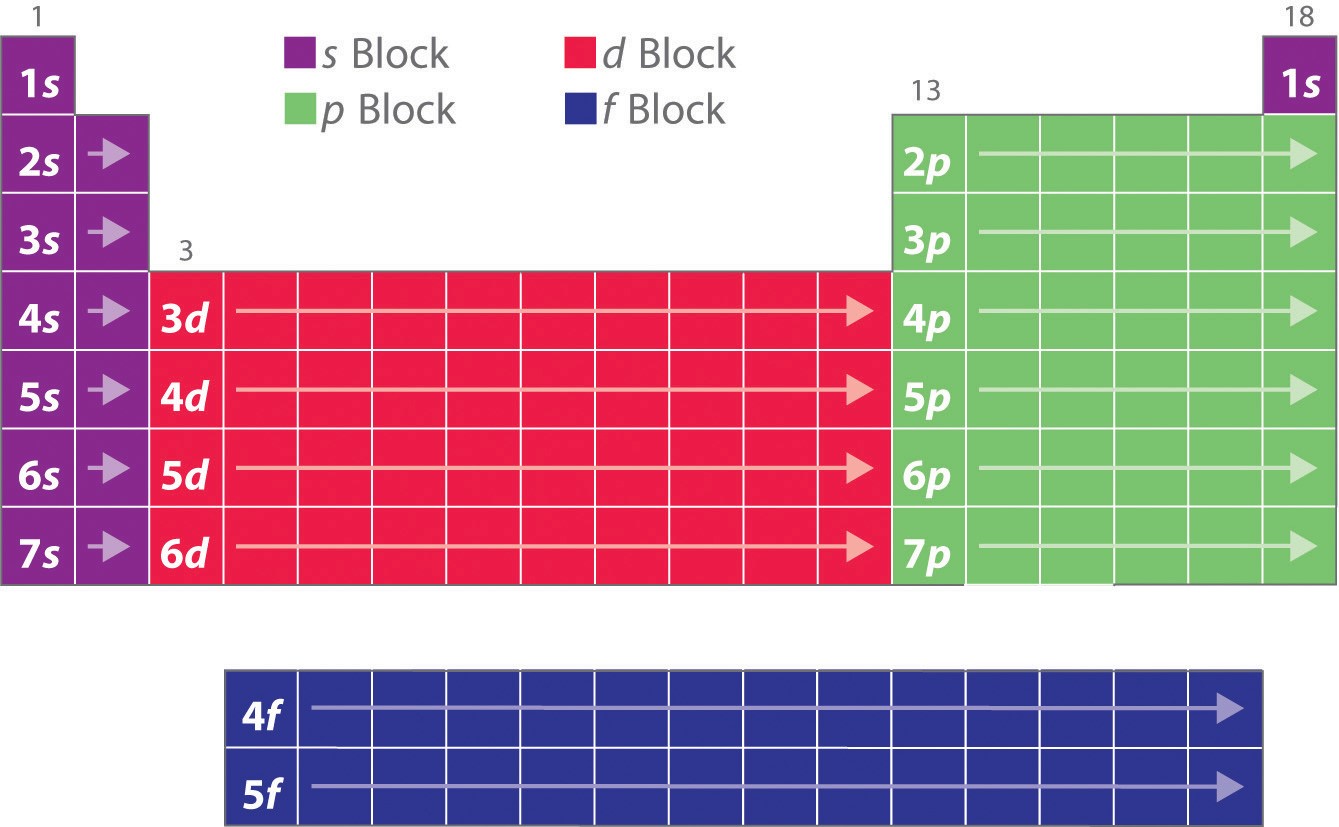
各軌道は最大2個の電子を持つことができるので、sブロックに2列、pブロックに6列、dブロックに10列、fブロックに14列あります。
水素とヘリウムはやや任意に配置されています。 水素はアルカリ金属ではないが、その1s1の電子配置はリチウム(2s1)や1列目の他の元素との類似性を示唆する。

例題 \(PageIndex{1})
周期表を使って2族のすべての元素(ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウム)の価電子配置を予想しなさい。
与えられたもの: 一連の元素
求められたもの: 価電子配置
戦略:
- 2 群元素が属する周期表のブロックを識別する。
- 各元素の価電子配置を、まず最も近い先行する希ガスの記号を用いて内殻の充填を示し、次にその価電子殻の主量子数、価電子軌道、および各軌道の価電子数を上付き文字として列挙して書きなさい。
解答:
A 2族元素は周期表のsブロックにあり、2族元素としてすべて2個の価電子を持っています。
B したがって、ベリリウムの電子配置は s2 となります。 次の元素であるマグネシウムは、n=3の主殻でまったく同じ電子配置:s2であると予想されます。
練習問題
17族のハロゲンの特徴的な価電子配置を周期表から予想せよ。
Answer
すべてns2np5の電子配置で、希ガスの電子配置には1電子足りない。 (重いハロゲンは、Rn の (n – 1)d10 副殻と (n – 2)f14 副殻も満たしていることに注意してください; しかし、これらは彼らの化学に大きな影響を与えません。