Lernziele
- Die Anordnung der Atome im Periodensystem in Blöcken zuzuordnen, die der Besetzung der ns-, np-, nd- und nf-Orbitale entsprechen
Wie Sie gelernt haben, erklären die Elektronenkonfigurationen der Elemente die ansonsten eigentümliche Form des Periodensystems. Obwohl das Periodensystem ursprünglich auf der Grundlage physikalischer und chemischer Ähnlichkeiten zwischen den Elementen innerhalb der Gruppen aufgebaut wurde, sind diese Ähnlichkeiten letztlich auf die Energieniveaus der Orbitale und das Pauli-Prinzip zurückzuführen, die dazu führen, dass die einzelnen Unterschalen in einer bestimmten Reihenfolge gefüllt werden. Infolgedessen kann das Periodensystem in „Blöcke“ unterteilt werden, die der Art der zu besetzenden Unterschale entsprechen, wie in Abbildung \(\PageIndex{1}\) dargestellt. Die beiden Spalten auf der linken Seite, der so genannte s-Block, bestehen beispielsweise aus Elementen, bei denen die ns-Orbitale gefüllt werden. Die sechs Spalten auf der rechten Seite, Elemente, in denen die np-Orbitale gefüllt sind, bilden den p-Block. Dazwischen liegen die 10 Spalten des d-Blocks, Elemente, in denen die (n – 1)d-Orbitale besetzt sind. Ganz unten liegen die 14 Spalten des f-Blocks, Elemente, in denen die (n – 2)f-Orbitale besetzt sind. Da zwei Elektronen pro Orbital untergebracht werden können, entspricht die Anzahl der Spalten in jedem Block der maximalen Elektronenkapazität der Unterschale: 2 für ns, 6 für np, 10 für (n – 1)d und 14 für (n – 2)f. Innerhalb jeder Spalte hat jedes Element die gleiche Valenzelektronenkonfiguration – zum Beispiel ns1 (Gruppe 1) oder ns2np1 (Gruppe 13). Wie Sie sehen werden, spiegelt sich dies in wichtigen Ähnlichkeiten in der chemischen Reaktivität und den Bindungen der Elemente in jeder Spalte wider.
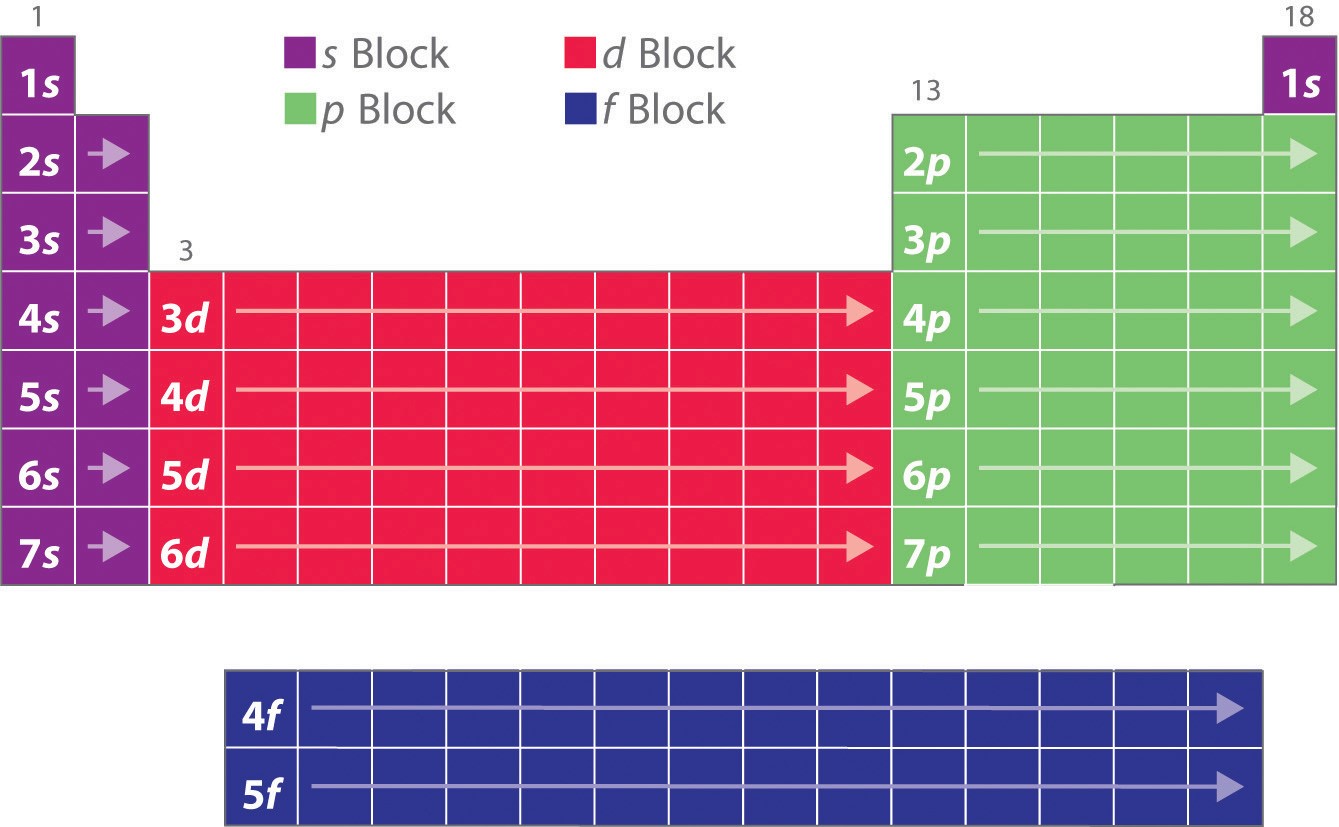
Da jedes Orbital maximal 2 Elektronen haben kann, gibt es 2 Spalten im s-Block, 6 Spalten im p-Block, 10 Spalten im d-Block und 14 Spalten im f-Block.
Wasserstoff und Helium sind etwas willkürlich angeordnet. Obwohl Wasserstoff kein Alkalimetall ist, deutet seine 1s1-Elektronenkonfiguration auf eine Ähnlichkeit mit Lithium (2s1) und den anderen Elementen in der ersten Spalte hin. Obwohl Helium mit einer gefüllten ns-Unterschale chemisch anderen Elementen mit einer ns2-Elektronenkonfiguration ähnlich sein sollte, dominiert die geschlossene Hauptschale seine Chemie, was seine Platzierung über Neon auf der rechten Seite rechtfertigt.
Beispiel \(\PageIndex{1}\)
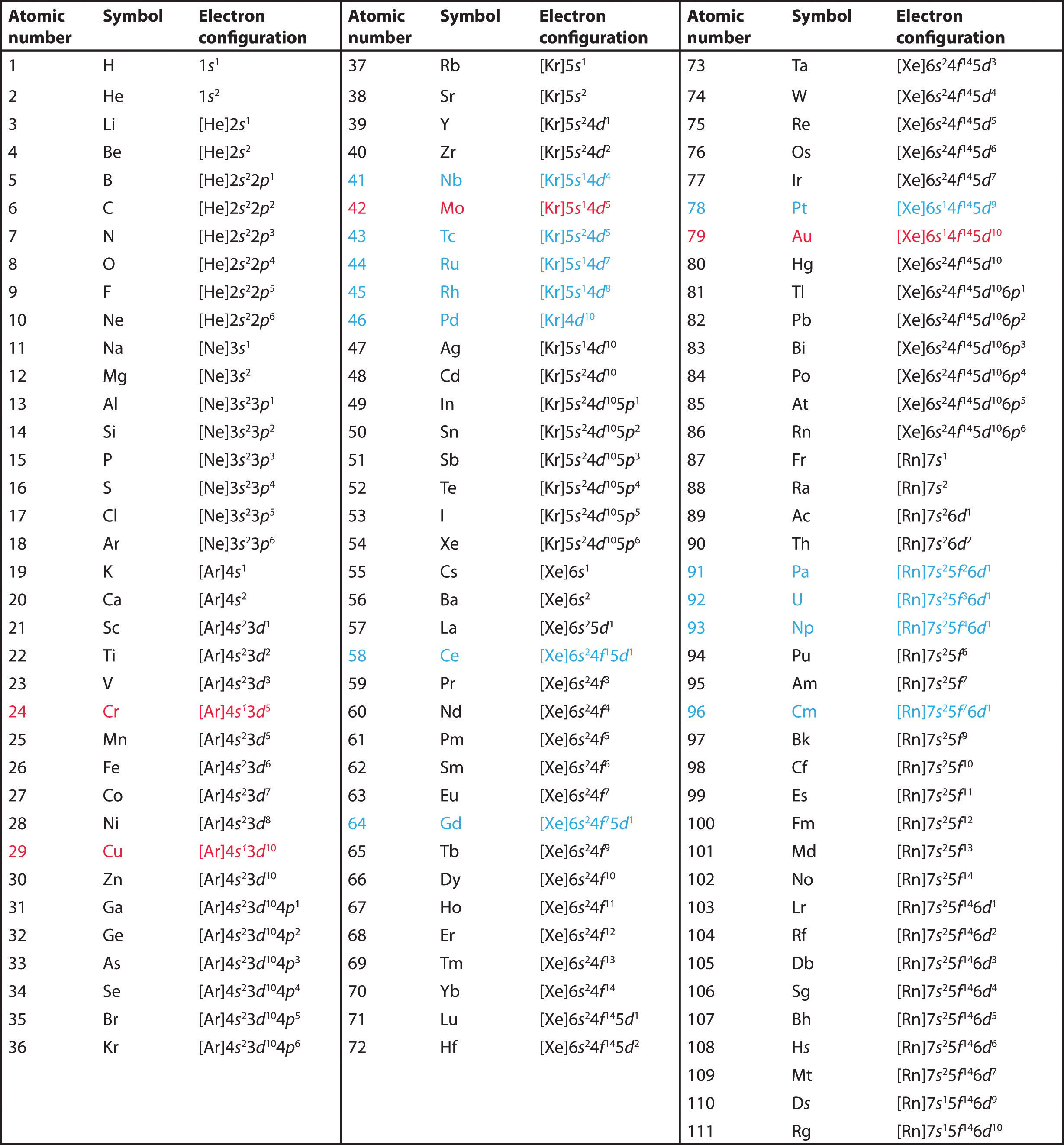
Benutzen Sie das Periodensystem, um die Valenzelektronenkonfiguration aller Elemente der Gruppe 2 (Beryllium, Magnesium, Calcium, Strontium, Barium und Radium) vorherzusagen.
Gegeben: Reihe der Elemente
Gefragt: Valenzelektronenkonfigurationen
Strategie:
- Bestimmen Sie den Block im Periodensystem, zu dem die Elemente der Gruppe 2 gehören. Finde das nächstgelegene Edelgas vor jedem Element und gib die Hauptquantenzahl der Valenzschale jedes Elements an.
- Schreibe die Valenzelektronenkonfiguration jedes Elements, indem du zuerst die gefüllten inneren Schalen mit dem Symbol des nächstgelegenen Edelgases angibst und dann die Hauptquantenzahl seiner Valenzschale, seine Valenzorbitale und die Anzahl der Valenzelektronen in jedem Orbital als hochgestellte Zahlen auflistest.
Lösung:
A Die Elemente der Gruppe 2 stehen im s-Block des Periodensystems und haben als Elemente der Gruppe 2 alle zwei Valenzelektronen. Beginnen wir mit Beryllium, so sehen wir, dass das nächsthöhere Edelgas Helium ist und dass die Hauptquantenzahl seiner Valenzschale n = 2 ist.
B Beryllium hat also eine s2-Elektronenkonfiguration. Das nächstniedrigere Element, Magnesium, wird voraussichtlich genau die gleiche Elektronenanordnung in der Hauptschale n = 3 haben: s2. Durch Extrapolation erwarten wir, dass alle Elemente der Gruppe 2 eine ns2-Elektronenkonfiguration haben.
Übung \(\PageIndex{1}\)
Verwenden Sie das Periodensystem, um die charakteristische Valenzelektronenkonfiguration der Halogene in Gruppe 17 vorherzusagen.
Antwort
Alle haben eine ns2np5-Elektronenkonfiguration, ein Elektron weniger als eine Edelgas-Elektronenkonfiguration. (Beachten Sie, dass die schwereren Halogene auch gefüllte (n – 1)d10-Unterschalen sowie eine (n – 2)f14-Unterschale für Rn haben; diese beeinflussen ihre Chemie jedoch in keiner Weise.