Leerdoelen
- De ordening van atomen in het periodiek systeem correleren in blokken die overeenkomen met de vulling van de ns-, np-, nd- en nf-banen
Zoals je hebt geleerd, verklaren de elektronenconfiguraties van de elementen de anders zo eigenaardige vorm van het periodiek systeem. Hoewel het periodiek systeem oorspronkelijk was georganiseerd op basis van fysische en chemische overeenkomsten tussen de elementen binnen groepen, zijn deze overeenkomsten uiteindelijk toe te schrijven aan de energieniveaus van de banen en het Pauli-principe, die ervoor zorgen dat de afzonderlijke subschillen in een bepaalde volgorde worden gevuld. Als gevolg daarvan kan het periodiek systeem worden onderverdeeld in “blokken” die overeenkomen met het type subschil dat wordt gevuld, zoals geïllustreerd in figuur (PaginaIndex{1}). Bijvoorbeeld, de twee kolommen links, bekend als het s-blok, bestaan uit elementen waarin de ns-banen worden gevuld. De zes kolommen aan de rechterkant, elementen waarin de np-banen worden gevuld, vormen het p-blok. Daartussen staan de 10 kolommen van het d-blok, elementen waarin de (n – 1)d-banen worden gevuld. Onderaan liggen de 14 kolommen van het f-blok, elementen waarin de (n – 2)f-banen worden gevuld. Omdat per baan twee elektronen kunnen worden ondergebracht, is het aantal kolommen in elk blok gelijk aan de maximale elektronencapaciteit van de subschil: 2 voor ns, 6 voor np, 10 voor (n – 1)d, en 14 voor (n – 2)f. Binnen elke kolom heeft elk element dezelfde valentie-elektronenconfiguratie, bijvoorbeeld ns1 (groep 1) of ns2np1 (groep 13). Zoals u zult zien, wordt dit weerspiegeld in belangrijke overeenkomsten in de chemische reactiviteit en de binding voor de elementen in elke kolom.
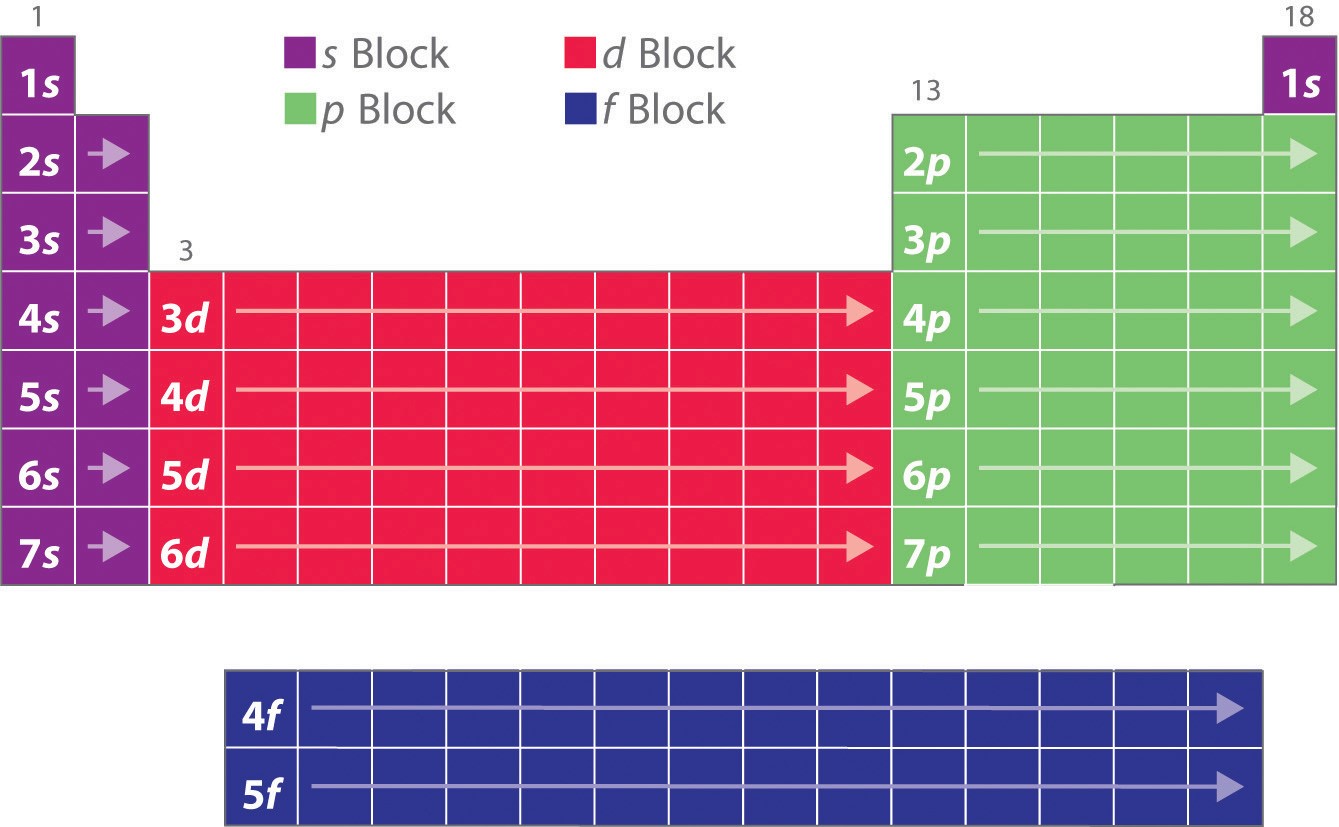
Omdat elke schil maximaal 2 elektronen kan hebben, zijn er 2 kolommen in het s-blok, 6 kolommen in het p-blok, 10 kolommen in het d-blok, en 14 kolommen in het f-blok.
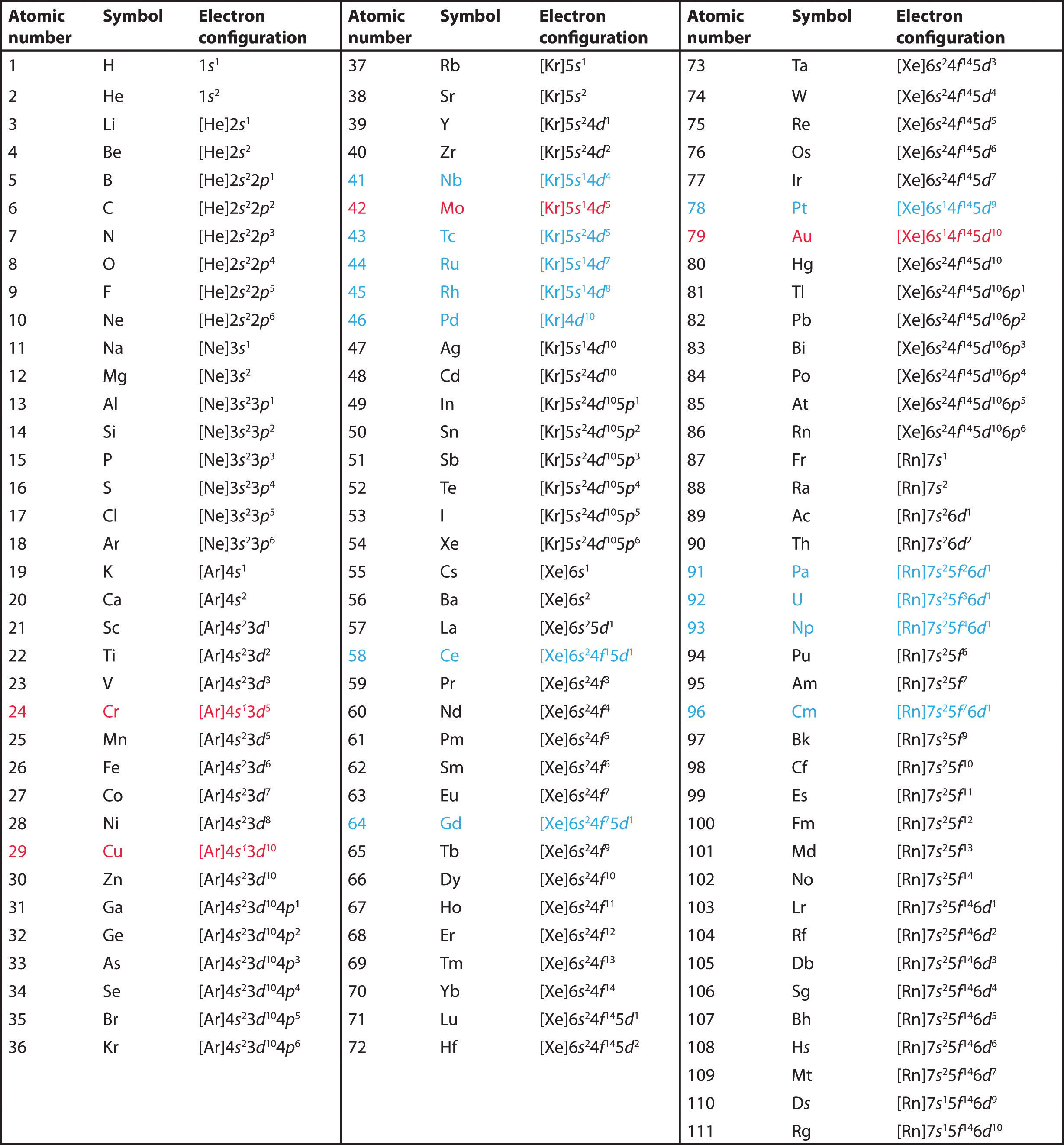
Waterstof en helium zijn enigszins willekeurig geplaatst. Hoewel waterstof geen alkalimetaal is, suggereert zijn elektronenconfiguratie van 1s1 een overeenkomst met lithium (2s1) en de andere elementen in de eerste kolom. Hoewel helium, met een gevulde ns-subschil, chemisch gezien vergelijkbaar zou moeten zijn met andere elementen met een ns2 elektronenconfiguratie, domineert de gesloten hoofdschil zijn chemie, wat zijn plaatsing boven neon rechts rechtvaardigt.
Voorbeeld
Gebruik het periodiek systeem om de valentie-elektronenconfiguratie van alle elementen van groep 2 (beryllium, magnesium, calcium, strontium, barium, en radium) te voorspellen.
Gegeven: reeks elementen
Vraag: valentie-elektronenconfiguraties
Strategie:
- Identificeer het blok in het periodiek systeem waartoe de elementen van groep 2 behoren. Zoek het dichtstbijzijnde edelgas dat aan elk element voorafgaat en noem het hoofdkwantumgetal van de valentieschil van elk element.
- Schrijf de valentie-elektronenconfiguratie van elk element door eerst de gevulde binnenste schillen aan te geven met behulp van het symbool van het dichtstbijzijnde voorgaande edelgas en vermeld vervolgens het hoofdkwantumgetal van zijn valentieschil, zijn valentiebanen en het aantal valentie-elektronen in elke baan als superscripts.
Oplossing:
A De elementen van groep 2 staan in het s-blok van het periodiek systeem, en als groep 2-elementen hebben ze allemaal twee valentie-elektronen. Beginnend met beryllium, zien we dat het meest nabije voorgaande edelgas helium is en dat het hoofdkwantumgetal van zijn valentieschil n = 2 is.
B Beryllium heeft dus een s2 elektronenconfiguratie. Het volgende element naar beneden, magnesium, zal naar verwachting precies dezelfde rangschikking van elektronen in de n = 3 valentieschil hebben: s2. Door extrapolatie verwachten we dat alle elementen van groep 2 een ns2 elektronenconfiguratie hebben.
Oefening
PageIndex{1})
Gebruik het periodiek systeem om de karakteristieke valentie-elektronenconfiguratie van de halogenen in groep 17 te voorspellen.
Antwoord
Alle hebben een ns2np5 elektronenconfiguratie, één elektron minder dan een edelgas-elektronenconfiguratie. (Merk op dat de zwaardere halogenen ook gevulde (n – 1)d10 subschillen hebben, evenals een (n – 2)f14 subschil voor Rn; deze hebben echter geen significante invloed op hun chemie.