Tanulmányi célok
- Az atomoknak a periódusos rendszerben való elrendezésének összefüggésbe hozása az ns, np, nd és nf pályák kitöltésének megfelelő blokkokban
Amint tanultad, az elemek elektronkonfigurációi magyarázzák a periódusos rendszer egyébként sajátos alakját. Bár a táblázatot eredetileg a csoportokon belüli elemek közötti fizikai és kémiai hasonlóságok alapján szervezték, ezek a hasonlóságok végső soron a pályák energiaszintjeinek és a Pauli-elvnek tulajdoníthatók, amelyek miatt az egyes alhéjak meghatározott sorrendben töltődnek fel. Ennek eredményeképpen a periódusos rendszer “blokkokra” osztható a betöltött alhéj típusának megfelelően, amint azt a \(\PageIndex{1}\) ábra szemlélteti. Például a bal oldali két oszlop, az úgynevezett s blokk olyan elemekből áll, amelyekben az ns pályák vannak kitöltve. A jobb oldali hat oszlop, amelyekben az np orbitálisok vannak kitöltve, alkotják a p blokkot. A kettő között található a d-blokk 10 oszlopa, olyan elemek, amelyekben az (n – 1)d pályák vannak kitöltve. Alul az f blokk 14 oszlopa található, azok az elemek, amelyekben az (n – 2)f orbitálok vannak kitöltve. Mivel egy orbitálison két elektron fér el, az egyes blokkok oszlopainak száma megegyezik az alhéj maximális elektronkapacitásával: 2 az ns, 6 az np, 10 az (n – 1)d és 14 az (n – 2)f esetében. Az egyes oszlopokon belül minden elemnek ugyanaz a valenciaelektron-konfigurációja – például ns1 (1. csoport) vagy ns2np1 (13. csoport). Mint látni fogjuk, ez az egyes oszlopokban szereplő elemek kémiai reakcióképességében és kötéseiben is fontos hasonlóságokat mutat.
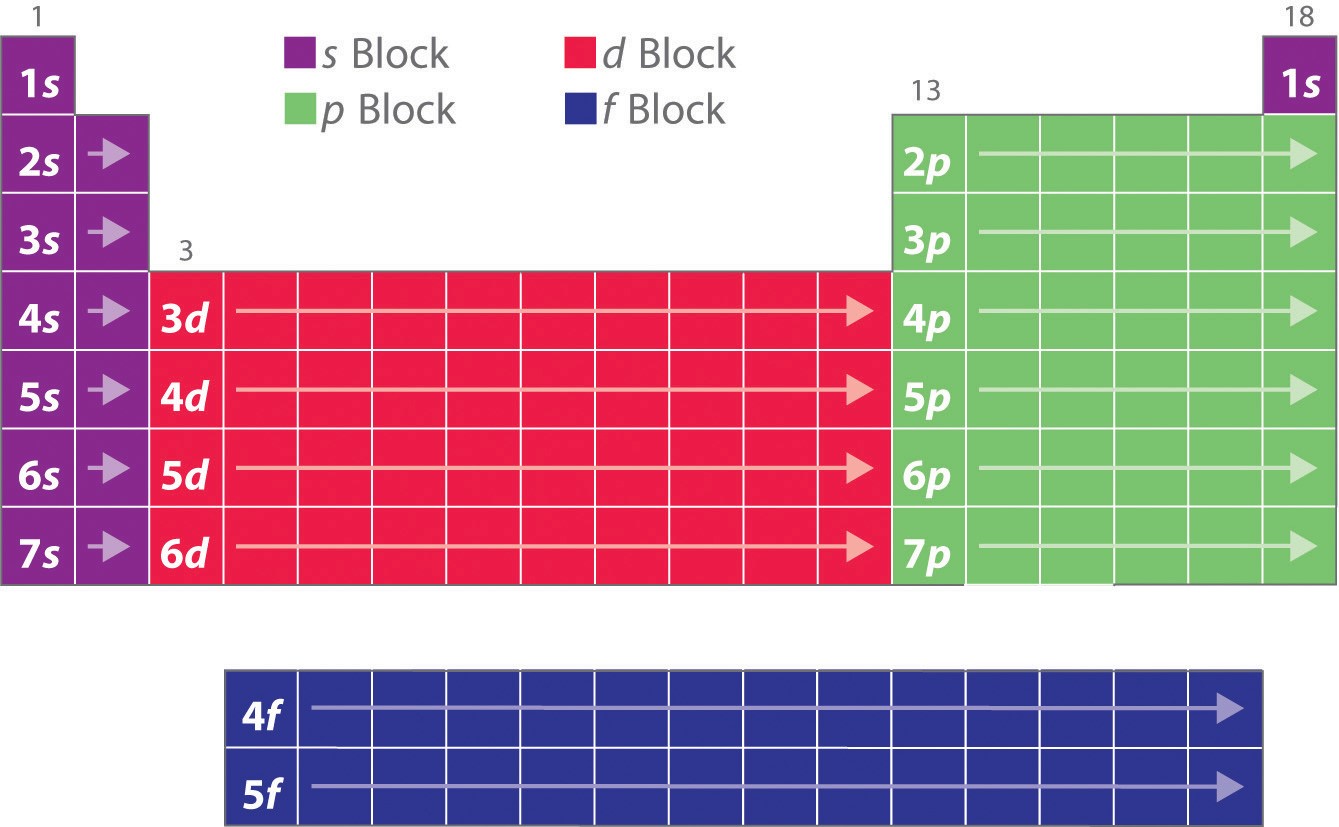
Mert mivel minden orbitálon legfeljebb 2 elektron lehet, az s-blokkban 2, a p-blokkban 6, a d-blokkban 10, az f-blokkban pedig 14 oszlop található.
A hidrogén és a hélium elhelyezése kissé önkényes. Bár a hidrogén nem alkálifém, 1s1 elektronkonfigurációja hasonlóságot sugall a lítiummal (2s1) és az első oszlopban lévő többi elemmel. Bár a héliumnak a kitöltött ns alhéjjal kémiailag hasonlónak kellene lennie az ns2 elektronkonfigurációjú elemekhez, a zárt főhéj dominál a kémiájában, ami indokolja a neon fölé helyezését a jobb oldalon.
Példa \(\PageIndex{1}\)
A periódusos rendszer segítségével jósolja meg a 2. csoport összes elemének (berillium, magnézium, kalcium, stroncium, bárium és rádium) valenciaelektron-konfigurációját.
Adott: az elemek sorozata
Kérdés: valenciaelektron-konfigurációk
Stratégia:
- Találd meg a periódusos rendszerben azt a blokkot, amelybe a 2. csoport elemei tartoznak. Keresse meg az egyes elemeket megelőző legközelebbi nemesgázt, és azonosítsa az egyes elemek valenciahéjának fő kvantumszámát.
- Írd fel az egyes elemek valenciaelektron-konfigurációját úgy, hogy először a betöltött belső héjakat jelzed a legközelebbi megelőző nemesgáz jelével, majd felsorolod a valenciahéj fő kvantumszámát, a valenciapályákat és az egyes pályákon lévő valenciaelektronok számát, mint feliratokat.
megoldás:
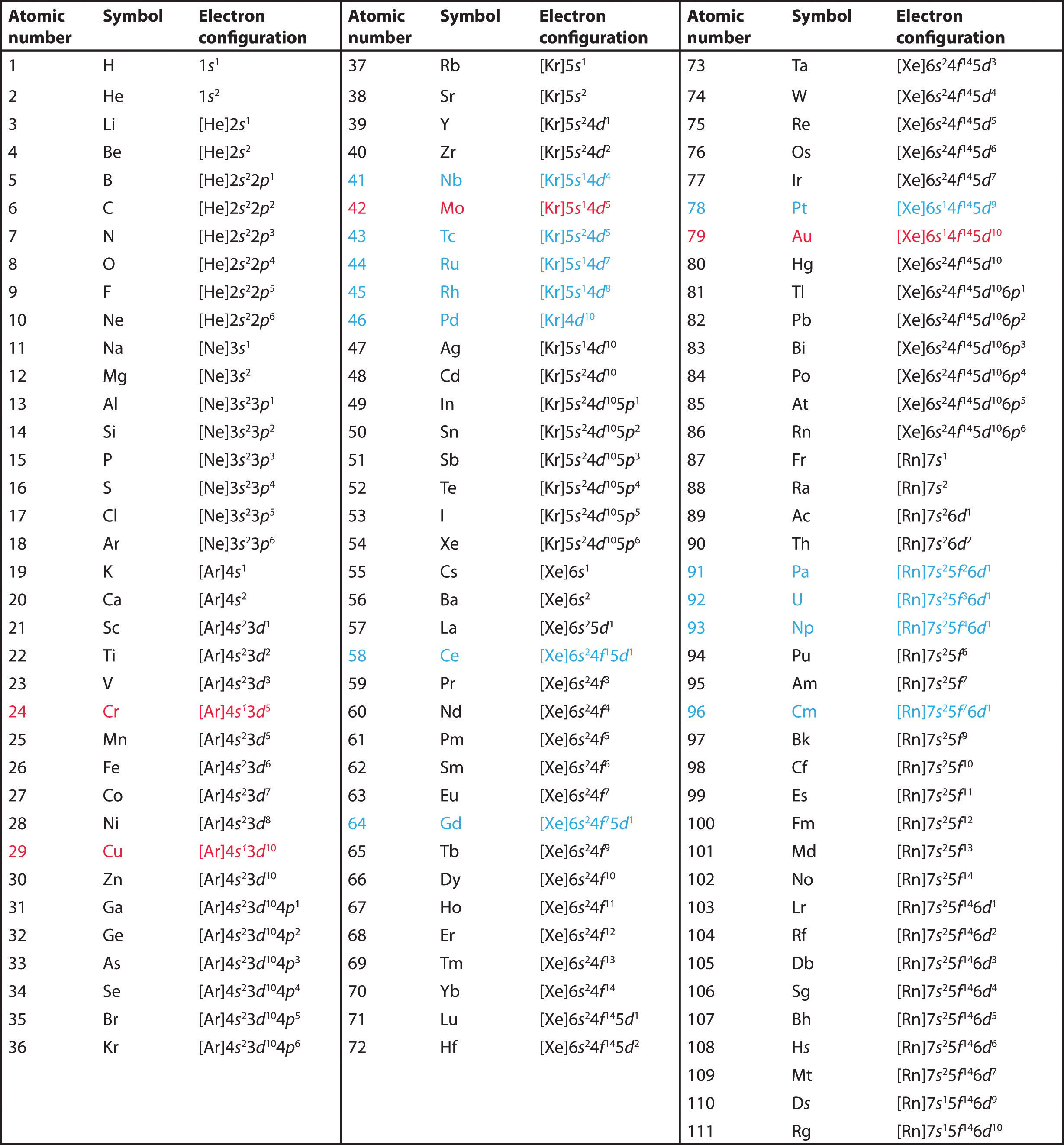
A A 2. csoportba tartozó elemek a periódusos rendszer s blokkjában találhatók, és mint 2. csoportba tartozó elemek, mindegyiknek két valenciaelektronja van. A berilliummal kezdve azt látjuk, hogy a legközelebbi előd nemesgáza a hélium, és hogy valenciahéjának fő kvantumszáma n = 2.
B A berillium tehát s2 elektronkonfigurációval rendelkezik. A következő elem, a magnézium várhatóan pontosan ugyanilyen elrendezésű elektronokkal rendelkezik az n = 3 főhéjban: s2. Extrapolációval a 2. csoport összes elemének ns2 elektronkonfigurációját várjuk.
Feladat \(\PageIndex{1}\)
A periódusos rendszer segítségével jósolja meg a 17. csoportba tartozó halogének jellegzetes valenciaelektron-konfigurációját.
Válasz
Mindegyiknek ns2np5 elektronkonfigurációja van, egy elektron hiányzik a nemesgáz elektronkonfigurációhoz. (Megjegyzendő, hogy a nehezebb halogének is rendelkeznek kitöltött (n – 1)d10 alhéjjal, valamint az Rn esetében egy (n – 2)f14 alhéjjal; ezek azonban nem befolyásolják jelentősen a kémiájukat.