Cíle výuky
- Srovnat uspořádání atomů v periodické tabulce s výsledky v blocích odpovídajících zaplnění orbitalů ns, np, nd a nf
Jak jste se dozvěděli, elektronové konfigurace prvků vysvětlují jinak zvláštní tvar periodické tabulky. Ačkoli byla tabulka původně uspořádána na základě fyzikálních a chemických podobností mezi prvky v rámci skupin, tyto podobnosti lze nakonec přičíst orbitálním energetickým hladinám a Pauliho principu, které způsobují, že jednotlivé podpouzdra jsou vyplněna v určitém pořadí. V důsledku toho lze periodickou tabulku rozdělit do „bloků“, které odpovídají typu vyplňované podpouzdra, jak je znázorněno na obrázku \(\PageIndex{1}\). Například dva sloupce vlevo, známé jako blok s, se skládají z prvků, v nichž jsou vyplněny orbitaly ns. Šest sloupců vpravo, tedy prvky, v nichž jsou vyplňovány orbitaly np, tvoří blok p. Mezi nimi je deset sloupců bloku d, tedy prvků, v nichž jsou vyplněny orbitaly (n – 1)d. Ve spodní části leží 14 sloupců bloku f, tedy prvků, v nichž jsou vyplněny (n – 2)f orbitaly. Protože na jeden orbital lze umístit dva elektrony, je počet sloupců v každém bloku stejný jako maximální elektronová kapacita podskupiny: 2 pro ns, 6 pro np, 10 pro (n – 1)d a 14 pro (n – 2)f. V každém sloupci má každý prvek stejnou valenční elektronovou konfiguraci – například ns1 (skupina 1) nebo ns2np1 (skupina 13). Jak uvidíte, odráží se to v důležitých podobnostech v chemické reaktivitě a vazbě pro prvky v každém sloupci.
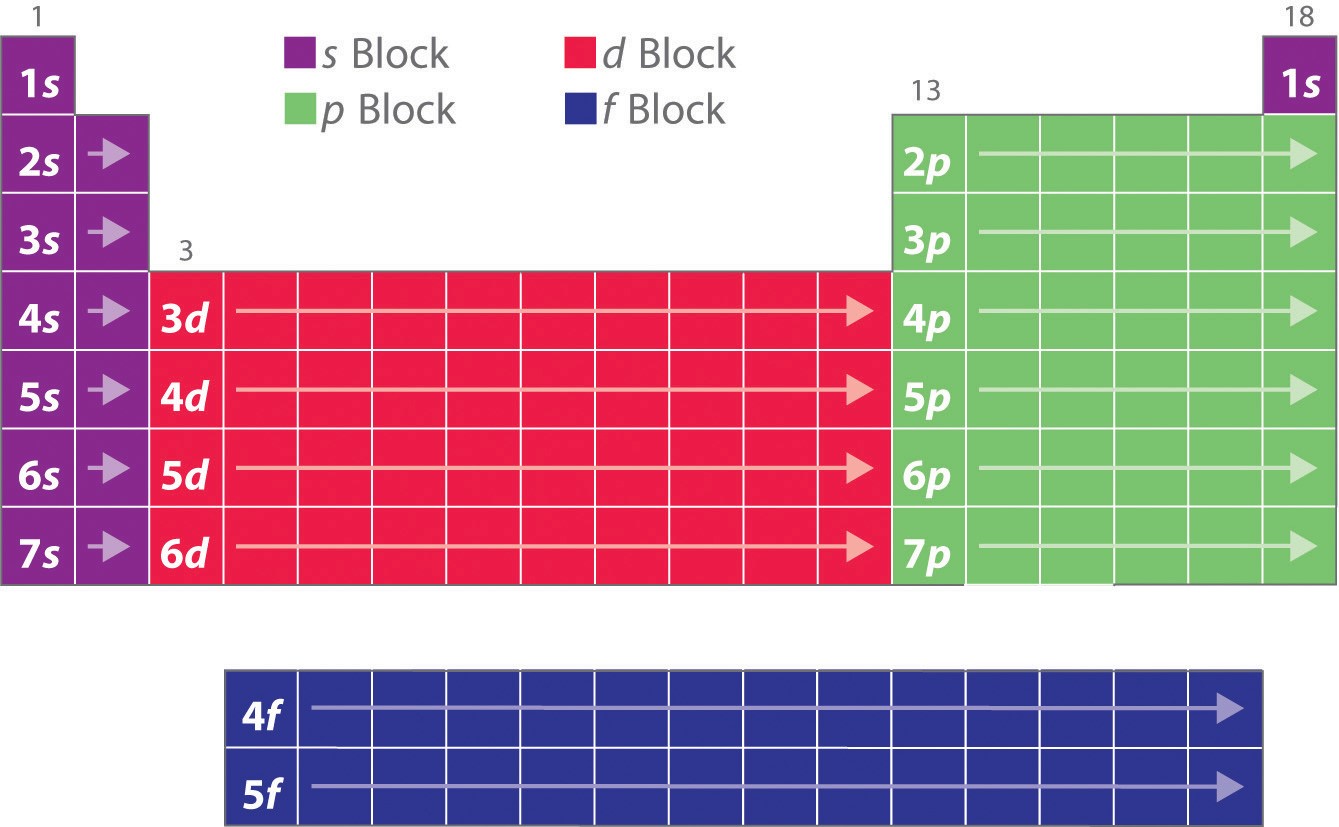
Protože každý orbital může mít maximálně 2 elektrony, jsou v bloku s 2 sloupce, v bloku p 6 sloupců, v bloku d 10 sloupců a v bloku f 14 sloupců.
Vodík a helium jsou umístěny poněkud libovolně. Přestože vodík není alkalický kov, jeho elektronová konfigurace 1s1 naznačuje podobnost s lithiem (2s1) a ostatními prvky v prvním sloupci. Ačkoli by se helium s vyplněnou elektronovou konfigurací ns mělo chemicky podobat ostatním prvkům s elektronovou konfigurací ns2, jeho chemii dominuje uzavřená hlavní slupka, což odůvodňuje jeho umístění nad neon vpravo.

Příklad \(\PageIndex{1}\)
Předpovězte z periodické tabulky valenční elektronovou konfiguraci všech prvků 2. skupiny (beryllium, hořčík, vápník, stroncium, baryum a radium).
Dáno: řada prvků
Zadáno: valenční elektronové konfigurace
Strategie:
- Určete blok v periodické tabulce, do kterého patří prvky 2. skupiny. Vyhledejte nejbližší vzácný plyn předcházející každému prvku a určete hlavní kvantové číslo valenční slupky každého prvku.
- Napište valenční elektronovou konfiguraci každého prvku tak, že nejprve označíte zaplněné vnitřní slupky pomocí symbolu nejbližšího předcházejícího vzácného plynu a poté uvedete hlavní kvantové číslo jeho valenční slupky, jeho valenční orbitaly a počet valenčních elektronů v každém orbitalu jako horní indexy.
Řešení:
A Prvky skupiny 2 jsou v bloku s periodické tabulky a jako prvky skupiny 2 mají všechny dva valenční elektrony. Začneme-li beryliem, vidíme, že jeho nejbližším předchozím vzácným plynem je helium a že hlavní kvantové číslo jeho valenční slupky je n = 2.
B Berylium má tedy elektronovou konfiguraci s2. Předpokládá se, že další následující prvek, hořčík, bude mít přesně stejné uspořádání elektronů v hlavní slupce n = 3: s2. Extrapolací očekáváme, že všechny prvky skupiny 2 budou mít elektronovou konfiguraci ns2.
Cvičení \(\PageIndex{1}\)
Pomocí periodické tabulky předpovězte charakteristickou valenční elektronovou konfiguraci halogenů skupiny 17.
Odpověď
Všechny mají elektronovou konfiguraci ns2np5, tedy o jeden elektron méně než elektronovou konfiguraci vzácného plynu. (Všimněte si, že těžší halogeny mají také vyplněnou (n – 1)d10 podpouzdra, stejně jako (n – 2)f14 podpouzdra pro Rn; ty však nijak významně neovlivňují jejich chemii.